Problema nº 2 de ley de Dalton, ley de las proporciones múltiples - TP05
Enunciado del ejercicio nº 2
El nitrógeno y el oxígeno forman varios compuestos, dos de los cuales tienen la siguiente composición:
Compuesto 1: 46,69 % de N y 53,31 % de O
Compuesto 2: 30,44 % de N y 69,56 % de O
Demostrar que se verifica la ley de Dalton.
Solución
Aplicando la ley de Proust hallamos la masa de oxígeno que se combina con 1 g de nitrógeno en cada compuesto. Tomamos el porcentaje de cada elemento equivalente a su masa considerando 100 % como 100 g de compuesto:
Compuesto 1
![]()
Compuesto 2
![]()
Comparamos ambos resultados dividiendo por el menor de ellos tenemos:
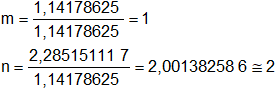
En este caso m y n son respectivamente 1 y 2 (números enteros y pequeños).
Se verifica la ley de Dalton.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP05
- | Siguiente ›
Ejemplo, aplicación de la ley de las proporciones múltiples