Problema nº 7 cálculo de densidad de la materia, determinación de masa - TP08
Enunciado del ejercicio nº 7
El ácido de baterías tiene un peso específico relativo de 1,285 y contiene 38 % en peso de H₂SO₄. ¿Cuántos gramos de H₂SO₄ puro contendrá un litro de ácido de batería?
Desarrollo
Datos:
ρᵣ = 1,285
CH₂SO₄ = 38 %
V₂ = 1 l
Fórmulas:
![]()
Solución
Aplicamos la fórmula de peso específico relativo:
![]()
Esta fórmula nos dice que:
![]()
O que por cada 1,000 kg de agua hay 1,285 kg de ácido, no importa la unidad de masa, solo importa que ambas sean iguales.
1,000 kg de agua ≅ 1,000 l de agua.
La concentración del ácido es del 38 % en peso, por tanto:
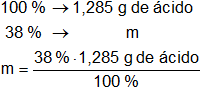
m = 0,4883 g de ácido
Convertimos las unidades:
![]()
m = 466,3 g
Resultado, la masa de H₂SO₄ puro por cada litro de ácido de batería es:
m = 466,3 g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP08
- | Siguiente ›
Ejemplo de cómo determinar la masa