Problema nº 10 de estequiometría de las disoluciones, neutralización de soluciones - TP02
Enunciado del ejercicio nº 10
Durante una titulación se neutralizan 30 ml de una solución de H₂SO₄ con 21 ml de solución 0,5 N de NaOH, calcular:
a) Normalidad de la solución ácida.
b) Molaridad de la solución ácida.
Desarrollo
Datos:
V₁ = 30 ml de solución de H₂SO₄
V₂ = 21 ml de solución 0,5 N de NaOH
Solución
a)
Método razonado
La ecuación estequiométrica balanceada es la siguiente:
2·NaOH + H₂SO₄ ⟶ Na₂SO₄ + 2·H₂O
Calculamos las masas de los moles que intervienen en la reacción en equilibrio:
2·NaOH: 2·(23 g + 16 g + 1 g) = 80 g
H₂SO₄: 2·1 g + 32 g + 4·16 g = 98 g
Na₂SO₄: 2·23 g + 32 g + 4·16 g = 142 g
2·H₂O: 2·(2·1 g + 16 g) = 36 g
![]()
Calculamos los equivalentes gramo.
El equivalente gramo del ácido sulfúrico es su mol dividido la cantidad de átomos de hidrógeno que posee en su mol.
![]()
Eg = 49 g (H₂SO₄)
El equivalente gramo del hidróxido de sodio es su mol dividido la cantidad de oxhidrilos que posee en su mol.
![]()
Eg = 40 g (NaOH)
Calculamos la masa de hidróxido de sodio que hay en 21 cm³ de solución 0,5 N:

x = 20 g de NaOH/l
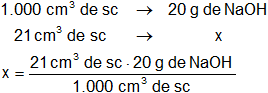
x = 0,42 g de NaOH (puro)
Calculamos la masa de ácido sulfúrico necesaria para neutralizar 0,42 g de NaOH, de la ecuación estequiométrica tenemos:
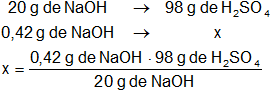
x = 0,5145 g de H₂SO₄ (puro)
Calculamos la masa de ácido sulfúrico que hay en 1.000 cm³ de solución:

x = 17,15 g de H₂SO₄
Finalmente calculamos la normalidad de la solución de ácido sulfúrico:
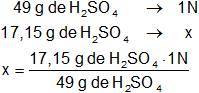
Resultado, la normalidad de los 30 ml de la solución de ácido sulfúrico es:
x = 0,35 N
Método sencillo
De otro modo, mucho más sencillo, teniendo en cuenta que "se neutraliza equivalente gramo a equivalente gramo" y que:
V₁·N₁ = V₂·N₂
Despejamos N₁:
![]()
Reemplazamos por los datos y calculamos:
![]()
N₁ = 0,35 N
b)
Molaridad (M): es el número de moles que tiene una solución por 1.000 cm³ de solución (sc).
De los cálculos anteriores sabemos que la masa de ácido sulfúrico en 1.000 cm³ de solución es 17,15 g.
Calculamos la molaridad:
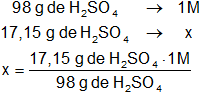
Resultado, la molaridad de los 30 ml de la solución de ácido sulfúrico es:
x = 0,175 M
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo, cómo calcular la normalidad y la molaridad en la neutralización de soluciones