Problema nº 8 de estequiometría de las disoluciones, neutralización de soluciones - TP03
Enunciado del ejercicio nº 8
Se neutralizan 50 ml de una solución de Fe(OH)₂ con 25 ml de solución 0,5 N de HCl, calcular:
a) Normalidad de la solución básica.
b) Molaridad de la solución básica.
Desarrollo
Datos:
V₁ = 50 cm³
V₂ = 25 cm³
N₂ = 0,5 N
Solución
a)
Teniendo en cuenta que "se neutraliza equivalente gramo a equivalente gramo" y que:
V₁·N₁ = V₂·N₂
Despejamos V₁:
![]()
Reemplazamos por los datos y calculamos:
![]()
Resultado, la normalidad de los 50 ml de la solución de Fe(OH)₂ es:
N₁ = 0,25 N
b)
Molaridad (M): es el número de moles que tiene una solución por 1.000 cm³ de solución (sc).
Calculamos el mol del hidróxido ferroso:
Fe(OH)₂: 56 g + 2·(16 g + 1 g) = 90 g
Del punto anterior sabemos que la normalidad es 0,25 N, entonces:
![]()
El equivalente gramo del hidróxido ferroso es su mol dividido la cantidad de oxhidrilos que posee en su mol.
![]()
Eg = 45 g Fe(OH)₂
Calculamos la masa de hidróxido ferroso que hay en 50 cm³ de solución 0,25 N:
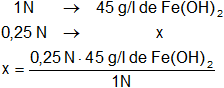
x = 11,25 g de Fe(OH)₂/l
Calculamos la molaridad:
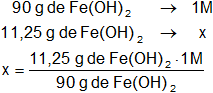
Resultado, la molaridad de los 50 ml de la solución de hidróxido ferroso es:
x = 0,125 M
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo calcular la normalidad y la molaridad en la neutralización de soluciones