Problema nº 7 de estequiometría de las disoluciones, normalidad y equivalente gramo - TP07
Enunciado del ejercicio nº 7
Una muestra de 48,4 ml de disolución de ácido clorhídrico necesita 1,24 g de carbonato de calcio puro para su neutralización completa. Calcular la normalidad del ácido.
Desarrollo
Datos:
V₁ = 48,7 ml
mCaCO₃ = 1,24 g
Fórmulas:
![]()
Solución
La ecuación estequiométrica balanceada es la siguiente:
2·HCl + CaCO₃ ⟶ CaCl₂ + CO₂ + H₂O
Disociamos el HCl y el CaCO₃:
HCl ⟶ H⁺ + Cl⁻ (libera 1 electrón ⟶ n = 1)
CaCO₃ ⟶ Ca²⁺ + CO₃²⁻ (libera 2 electrones ⟶ n = 2)
Calculamos el mol de ambos compuestos:
HCl: 1,00797 g + 35,453 g = 36,46097 g
CaCO₃: 40,08 g + 12,01115 g 3·15,9994 g = 100,08935 g
Determinamos el equivalente gramo de ambos compuestos:
![]()
EgHCl = 36,46097 g/mol
![]()
EgCaCO₃ = 50,044675 g/mol
El HCl y el CaCO₃ se neutralizan equivalente a equivalente, por tanto, para 1,24 g será:
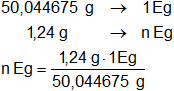
n = 0,02477786 Eg de CaCO₃
El mismo número de equivalentes gramo reacciona de HCl:
x = 0,02477786 Eg de HCl
Calculamos la normalidad de la solución de HCl:

x = 0,51193928 N
Por lo tanto, el Eg de ácido igual.
Resultado, la normalidad del ácido es:
0,512 N
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP07
- | Siguiente ›
Ejemplo, cómo calcular la normalidad en la neutralización de soluciones