Problema nº 8 de estequiometría de las disoluciones, volumen y masa - TP07
Enunciado del ejercicio nº 8
a) ¿Qué volumen de ácido sulfúrico 5 N se necesitan para neutralizar una disolución que contiene 2,5 g de hidróxido de sodio?
b) ¿Cuántos gramos de ácido sulfúrico puro se necesitan?
Desarrollo
Datos:
N₁ = 5 N
mNaOH = 2,5 g
Fórmulas:
![]()
Solución
La ecuación estequiométrica balanceada es la siguiente:
2·NaOH + H₂SO₄ ⟶ Na₂SO₄ + 2·H₂O
Disociamos el NaOH y el H₂SO₄:
NaOH ⟶ Na⁺ + OH⁻ (libera 1 electrón ⟶ n = 1)
H₂SO₄ ⟶ 2·H⁺ + SO₄²⁻ (libera 2 electrones ⟶ n = 2)
Calculamos el mol de ambos compuestos:
NaOH: 22,9898 g + 1,00797 g + 15,9994 g = 39,99717 g
H₂SO₄: 2·1,00797 g + 32,064 g 4·15,9994 g = 98,07754 g
Determinamos el equivalente gramo de ambos compuestos:
![]()
EgNaOH = 39,99717 g/mol
![]()
EgH₂SO₄ = 49,03877 g/mol
a)
El NaOH y el H₂SO₄ se neutralizan equivalente a equivalente, por tanto, para 2,50 g de NaOH será:
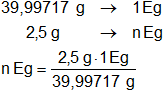
n Eg = 0,06250442 Eg de NaOH
El mismo número de equivalentes gramo reacciona de H₂SO₄:
x = 0,06250442 Eg de H₂SO₄
Calculamos el volumen de la solución de H₂SO₄:
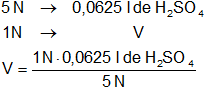
V = 0,01250088 l de H₂SO₄
Resultado a), el volumen de ácido sulfúrico 5 N es:
V₂ = 0,0125 l = 12,5 ml
b)
De acuerdo con la reacción expresada más arriba:
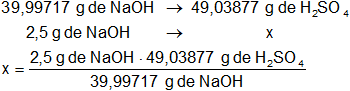
m = 3,065139984 g de H₂SO₄
Resultado b), la masa de ácido sulfúrico puro es:
m = 3,065 g de H₂SO₄
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP07
- | Siguiente ›
Ejemplo, cómo calcular el volumen y la masa en la neutralización de soluciones