Problema nº 2 de estequiometría de las disoluciones, masa del soluto - TP08
Enunciado del ejercicio nº 2
¿Cuánto NaNO₃ debe pesarse para preparar 50 ml de una disolución (sc) acuosa que contiene 70 mg de Na⁺ por litro?
Desarrollo
Datos:
mNa = 70 mg/l
VSc = 50 ml
Solución
Calculamos la masa del mol de nitrato de sodio:
NaNO₃: 22,9898 g + 14,0067 g + 3·15,9994 g = 84,9947 g
En un mol de nitrato de sodio hay 22,9898 de Na⁺.
Calculamos la masa de NaNO₃ que debe tener la solución de 1 litro:
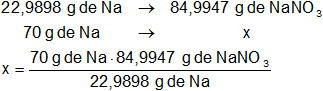
x = 258,7942914 g/l de NaNO₃
Luego:

x = 12,93971457 g de NaNO₃
Resultado, la cantidad de nitrato de sodio necesaria es:
m = 12,94 g de NaNO₃
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP08
- | Siguiente ›
Ejemplo, cómo calcular la masa del soluto en una solución