Problema nº 3 de estequiometría de las disoluciones, masa y normalidad en una neutralización - TP10
Enunciado del ejercicio nº 3
Se neutralizan 15 cm³ de solución de KOH con 12 cm³ de solución de HCl 0,1 N. Determinar:
a) La normalidad de la solución básica.
b) Los gramos de KOH que hay en los 15 cm³ de solución (sc).
Desarrollo
Datos:
V₁ = 15 cm³ de KOH
V₂ = 12 cm³ de HCl
N₂ = 0,1 N
Fórmulas:
V₁·N₁ = V₂·N₂
Solución
a)
Teniendo en cuenta que "se neutraliza equivalente gramo a equivalente gramo":
V₁·N₁ = V₂·N₂
Despejamos N₁:
![]()
Reemplazamos por los datos y calculamos:
![]()
N₁ = 0,08 N
Resultado a), la normalidad de una solución de KOH es:
N₁ = 0,08 N
b)
Calculamos el mol de KOH:
KOH: 39,102 g + 1,00797 g + 15,9994 g = 56,10937 g
Determinamos el equivalente gramo del hidróxido de potasio:
![]()
EgKOH = 56,10937 g/mol
Hallamos los equivalentes gramos que hay en 1.000 cm³ de solución 0,08 N de KOH:
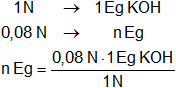
n Eg = 4,4887496 g de KOH 0,08 N
Finalmente, determinamos los gramos de KOH que hay en 15 cm³ de solución 0,08 N:
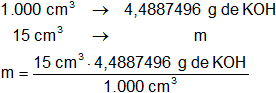
mKOH = 0,067331244 g
Resultado b), la masa de KOH que hay en los 15 cm³ de solución es:
mKOH = 0,0673 g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP10
- | Siguiente ›
Ejemplo, cómo calcular la normalidad y la masa en la neutralización de soluciones