Problema nº 6 de estequiometría de las disoluciones, volumen y equivalente gramo en una neutralización - TP10
Enunciado del ejercicio nº 6
Se neutralizan 250 ml de solución 0,2 M de ácido sulfúrico con solución de hidróxido de potasio 0,25 N. Calcular el volumen de solución básica utilizada y el número de equivalentes gramo de sal formados.
Desarrollo
Datos:
V₁ = 250 ml de H₂SO₄
M₁ = 0,2 M
N₂ = 0,25 N
Fórmulas:
![]()
V₁·N₁ = V₂·N₂
Solución
La ecuación estequiométrica balanceada es la siguiente:
2·KOH + H₂SO₄ ⟶ K₂SO₄ + 2·H₂O
Disociamos el H₂SO₄ y el K₂SO₄:
H₂SO₄ ⟶ 2·H⁺ + SO₄²⁻ (libera 2 electrones ⟶ n = 2)
K₂SO₄ ⟶ 2·K⁺ + SO₄²⁻ (libera 2 electrones ⟶ n = 2)
Calculamos el mol de los compuestos:
H₂SO₄: 2·1,00797 g + 32,064 g 4·15,9994 g = 98,07754 g
K₂SO₄: 2·39,102 g + 32,064 g 4·15,9994 g = 174,2656 g
Determinamos el equivalente gramo de ambos compuestos:
![]()
EgH₂SO₄ = 49,03877 g/mol
![]()
EgK₂SO₄ = 87,1328 g/mol
a)
El KOH y el H₂SO₄ se neutralizan equivalente a equivalente, por tanto, en la solución 0,2 M de H₂SO₄ hay:
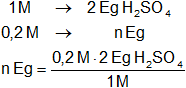
n = 0,4 Eg de H₂SO₄/l ≡ 0,4 N
Luego, hallamos el volumen necesario de solución de hidróxido de potasio 0,25 N:
V₁·N₁ = V₂·N₂
Despejamos V₂:
![]()
Reemplazamos por los datos y calculamos:
![]()
V₂ = 400 ml
Resultado a), el volumen necesario de solución de KOH es:
V₂ = 400 ml
b)
De acuerdo con la reacción expresada más arriba, el volumen y los equivalentes gramo:
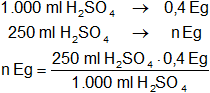
n = 0,1 Eg de K₂SO₄
Resultado b), el número de equivalentes gramo de sal formados es:
EgK₂SO₄ = 0,1
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP10
- | Siguiente ›
Ejemplo, cómo calcular el volumen utilizado en una neutralización y los equivalentes gramo de sal