Problema nº 6 de peso molecular - TP03
Enunciado del ejercicio nº 6
Hallar los pesos moleculares de los siguientes compuestos:
a) H₂SO₄
b) N₂
c) HNO₃
d) O₃
e) HCl
f) SO₃
g) NaOH
h) PbO₂
i) FeSO₄
j) Cl₂O₅
k) Fe₂(SO₄)₃
l) Pb₃(PO₄)₄
Desarrollo
Para hallar el valor de una molécula gramo o mol de una sustancia debemos conocer el valor de los pesos atómicos relativos de los átomos que la forman.
El mol es la suma de los pesos atómicos de todos los elementos que forman la molécula.
Solución
a) H₂SO₄
Los pesos atómicos de los elementos presentes en el ácido sulfúrico son:
mH = 1,00797 g
mS = 32,064 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
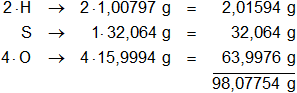
Respuesta: el peso molecular del H₂SO₄ es 98,07754 g
b) N₂
Los pesos atómicos de los elementos presentes en el nitrógeno gaseoso son:
mN = 14,0067 g
Multiplicamos por la cantidad de átomos presentes en la sustancia:
2·N ⟶ 2·14,0067 g = 28,0134 g
Respuesta: el peso molecular del N₂ es 28,0134 g
c) HNO₃
Los pesos atómicos de los elementos presentes en el ácido nítrico son:
mH = 1,00797 g
mN = 14,0067 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
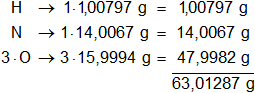
Respuesta: el peso molecular del HNO₃ es 63,01287 g
d) O₃
Los pesos atómicos de los elementos presentes en el ozono son:
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia:
3·O ⟶ 3·14,0067 g = 47,9982 g
Respuesta: el peso molecular del O₃ es 47,9982 g
e) HCl
Los pesos atómicos de los elementos presentes en el ácido clorhídrico son:
mH = 1,00797 g
mCl = 35,453 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
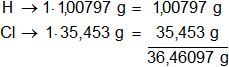
Respuesta: el peso molecular del HCl es 36,46097 g
f) SO₃
Los pesos atómicos de los elementos presentes en el trióxido de azufre son:
mS = 32,064 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
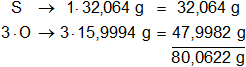
Respuesta: el peso molecular del SO₃ es 80,0622 g
g) NaOH
Los pesos atómicos de los elementos presentes en el hidróxido de sodio son:
mNa = 22,9898 g
mH = 1,00797 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
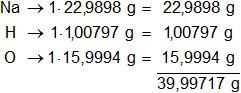
Respuesta: el peso molecular del NaOH es 39,99717 g
h) PbO₂
Los pesos atómicos de los elementos presentes en el óxido plúmbico son:
mPb = 207,19 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
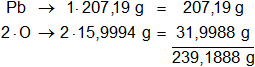
Respuesta: el peso molecular del PbO₂ es 239,1888 g
i) FeSO₄
Los pesos atómicos de los elementos presentes en el sulfato ferroso son:
mFe = 55,847 g
mS = 32,064 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
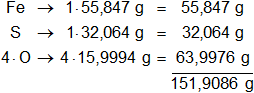
Respuesta: el peso molecular del FeSO₄ es 151,9086 g
j) Cl₂O₅
Los pesos atómicos de los elementos presentes en el óxido clórico son:
mCl = 35,453 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
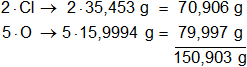
Respuesta: el peso molecular del Cl₂O₅ es 150,903 g
k) Fe₂(SO₄)₃
Los pesos atómicos de los elementos presentes en el sulfato férrico son:
mFe = 55,847 g
mS = 32,064 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
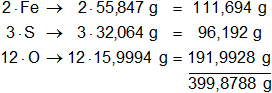
Respuesta: el peso molecular del Fe₂(SO₄)₃ es 399,8788 g
l) Pb₃(PO₄)₄
Los pesos atómicos de los elementos presentes en el fosfato plúmbico son:
mPb = 207,19 g
mP = 30,9738 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
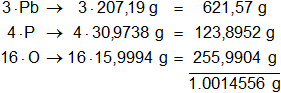
Respuesta: el peso molecular del Pb₃(PO₄)₄ es 1.001,4556 g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo calcular pesos moleculares de una sustancia