Problema nº 9 de volumen molar - TP04
Enunciado del ejercicio nº 9
¿Cuántas moléculas y átomos hay en 44,8 dm³ de oxígeno, medidos en CNPT?
Desarrollo
Datos:
Volumen de oxígeno = 44,8 dm³
Volumen molar = 22,4 dm³
1 mol/átomo gramo ≡ 6,02·10²³ moléculas/átomos (número de Avogadro)
Solución
a)
Calculamos el número de moléculas:
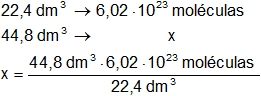
x = 1,204·10²⁴ moléculas
Respuesta a): en 44,8 dm³ de oxígeno hay 1,204·10²⁴ moléculas
b)
Calculamos el número de átomos teniendo en cuenta que la molécula de oxígeno es biatómica:
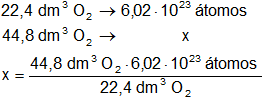
x = 2,408·10²⁴ átomos
Respuesta b): en 44,8 dm³ de oxígeno hay 2,408·10²⁴ átomos
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo calcular la cantidad de moléculas y átomos en el volumen de un gas