Problema nº 3 de teoría atómica - TP05
Enunciado del ejercicio nº 3
Hallar el número de moléculas que hay en 40 g de agua.
Desarrollo
Datos:
Átomos gramo O = 15,9994 g
Átomos gramo H = 1,00797 g
1 mol ≡ 6,02·10²³ moléculas (número de Avogadro)
Solución
Calculamos el mol de H₂O:
mH = 1,00797 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
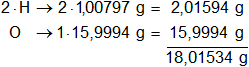
En un mol de agua hay 6,02·10²³ moléculas, calculamos las moléculas que hay en 40 g de agua:
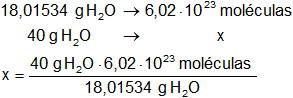
x = 1,3366·10²⁴ moléculas de agua
Respuesta: el número de moléculas que hay en 40 g de agua es 1,3366·10²⁴
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP05
- | Siguiente ›
Ejemplo, cómo calcular las moléculas en una sustancia