Problema nº 8 de moléculas gramo - TP05
Enunciado del ejercicio nº 8
¿Cuántas moléculas gramo de amoníaco (NH₃) hay en 5,2 g de ésta?
Desarrollo
Datos:
Átomos gramo N = 14,0067 g
Átomos gramo H = 1,00797 g
Solución
Calculamos el mol de amoníaco. Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
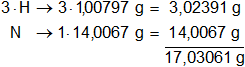
Calculamos las moléculas gramo de amoníaco:
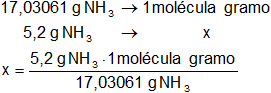
x = 3,05 moléculas gramo de NH₃
Respuesta: el número de moléculas que hay en 5,2 g de amoníaco es 0,3 moles
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP05
- | Siguiente ›
Ejemplo, cómo calcular las moléculas gramo en una cantidad de sustancia