Problema nº 4 de cantidad de moléculas y átomos - TP06
Enunciado del ejercicio nº 4
En una masa de ácido nítrico (HNO₃) hay 48 átomos gramo de oxígeno. Calcular:
a) Número de moles de ácido nítrico.
b) Número de moléculas de ácido nítrico.
c) Masa de nitrógeno.
d) Número de átomos de hidrógeno.
Desarrollo
Datos:
Átomos gramo O = 48
1 mol/átomo gramo ≡ 6,02·10²³ moléculas/átomos (número de Avogadro)
Solución
a)
Calculamos los moles de HNO₃ que corresponden a 48 átomos gramo de oxígeno:

n = 16 moles de HNO₃
Respuesta a): el número de moles de ácido nítrico es 16
b)
En una molécula gramo de ácido nítrico hay 3 átomos gramo de oxígeno, calculamos las moléculas de ácido nítrico que corresponden a 48 átomos gramo de oxígeno:
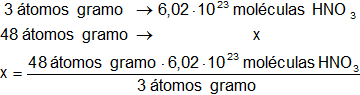
x = 9,632·10²⁴ moléculas de HNO₃
Respuesta b): el número de moléculas de ácido nítrico es 9,632·10²⁴
c)
En una molécula gramo de HNO₃ hay 3 átomo gramo de oxígeno, calculamos la masa que corresponde a 48 átomos gramo de oxígeno:

m = 224 g de N
Respuesta c): la masa de nitrógeno es 224 g
d)
En una molécula gramo de ácido nítrico hay 3 átomos gramo de oxígeno, calculamos la cantidad átomos de hidrógeno que corresponden a 48 átomos gramo de oxígeno:
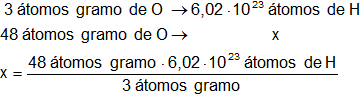
x = 9,632·10²⁴ átomos de H
Respuesta d): el número de átomos de hidrógeno es 9,632·10²⁴
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular los cantidad de moléculas y átomos contenidos en una sustancia