Problemas nº 8 e-h de enlaces químicos covalentes e iónico - TP01
Enunciado del ejercicio nº 8 e-h
Emplear puntos y asteriscos para indicar los electrones y representar las estructuras de:
e) Óxido de sodio (Na₂O).
f) Amoníaco (NH₃).
g) Cloruro de amonio (NH₄Cl).
h) Metano (CH₄).
Solución
Se emplearán solo los electrones de valencia.
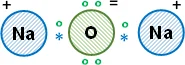
e) Óxido de sodio (Na₂O).
Electrones de valencia del sodio: 1
Electrones de valencia del oxígeno: 6
Metal y no metal, enlace iónico.
Esquema de la molécula con la distribución de los electrones empleando la estructura de Lewis:
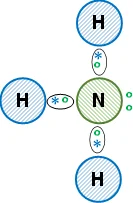
f) Amoníaco (NH₃).
Electrones de valencia del hidrógeno: 1
Electrones de valencia del nitrógeno: 5
Son no metales, enlace covalente.
Esquema de la molécula con la distribución de los electrones empleando la estructura de Lewis:
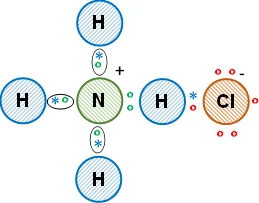
g) Cloruro de amonio (NH₄Cl).
Electrones de valencia del hidrógeno: 1
Electrones de valencia del nitrógeno: 5
Electrones de valencia del cloro: 7
Son no metales, enlace covalente.
Esquema de la molécula con la distribución de los electrones empleando la estructura de Lewis:
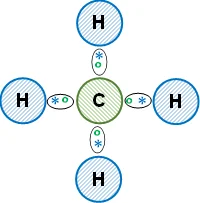
h) Metano (CH₄).
Electrones de valencia del hidrógeno: 1
Electrones de valencia del carbono: 4
Son no metales, enlace covalente.
Esquema de la molécula con la distribución de los electrones empleando la estructura de Lewis:
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo de enlaces covalentes e iónico