Problema nº 2 de velocidad de reacción, aumento de la superficie de contacto - TP01
Enunciado del ejercicio nº 2
Si la velocidad de descomposición del cinc por el ácido clorhídrico, es proporcional a su superficie, ¿cuánto más rápidamente se disolverán 1.000 cubos de cinc de 1 cm³ cada uno que uno de 1 dm³?
Desarrollo
Datos:
V₁ = 1 dm³
V₂ = 1 cm³
Cantidad = 1.000 cubos
Solución
Se trata de cubos por lo que sus caras son cuadrados y contiene 6 caras, el cálculo de su superficie es:
![]()
La superficie del cubo de 1 dm³ es:
![]()
La superficie un cubo de 1 cm³ es:
![]()
Reemplazamos y calculamos para hallar las superficies de cada cubo:
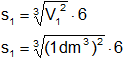
S₁ = 1 dm²·6
S₁ = 6 dm²
Para el cubo de 1 dm³ tenemos una superficie de contacto de 6 dm².
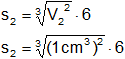
S₂ = 1 cm²·6
S₂ = 6 cm²
El enunciado dice que hay 1.000 cubos de 1 cm³, calculamos la superficie total:
S₂ total = 6 cm²·1.000
S₂ total = 6.000 cm²
Para poder comparar las superficies los valores deben estar en las mismas unidades:
S₂ total = 6.000 cm² = 60 dm²
Para los 1.000 cubos de 1 cm³ tenemos una superficie de contacto de 60 dm².
Comparamos:
![]()
R = 10
Respuesta: el aumento de superficie disolverá al zinc 10 veces más rápido.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo varía la velocidad de la reacción con el aumento de la superficie de contacto