Problema nº 3 de principio de Le Châtelier, variación de la presión - TP01
Enunciado del ejercicio nº 3
Describa aplicando el principio de Le Châtelier como afectará un aumento de presión a estas reacciones:
a) H₂(g) + Cl₂(g) ⇌ 2·HCl(g)
b) 2·H₂(g) + O₂(g) ⇌ 2·H₂O(g)
Solución
a)
Es una reacción de formación, todas las sustancias son gaseosas.
Comparamos los volúmenes que intervienen de cada sustancia:
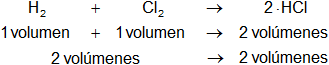
En la reacción intervienen igual cantidad de volúmenes de reactantes que de productos.
Según el principio de Le Châtelier, cuando los volúmenes de los reactantes y de los productos son iguales, el aumento de presión no modifica a la reacción.
Respuesta a): no la afecta.
b)
Es una reacción de formación, todas las sustancias son gaseosas.
Comparamos los volúmenes que intervienen de cada sustancia:
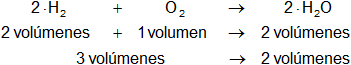
En la reacción intervienen más volúmenes de reactantes que de productos.
Según el principio de Le Châtelier, con el aumento de presión se produce más agua. La reacción se desplaza hacia la derecha.
Respuesta b): la favorece.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo se comporta una reacción con la variación de la presión