Problema nº 5 de entalpía de formación, calor de formación de un compuesto - TP08
Enunciado del ejercicio nº 5
¿Cuál es la cantidad de calor necesaria para obtener 1 kg de carburo de calcio (CaC₂) de acuerdo con la siguiente reacción?
CaO(s) + 3·C(s) ⟶ CaC₂(s) + CO(g)
Desarrollo
Datos:
HCaO = -152,0000208 kcal/mol
HC = 0 kcal/mol
HCO₂ = -14,328 kcal/mol
HCO = -26,395 kcal/mol
Solución
Expresamos la ecuación equilibrada de la reacción:
CaO + 3·C ⟶ CaC₂ + CO
Dada la reacción equilibrada, buscamos en la tabla de entalpías de formación la entalpía de cada sustancia:
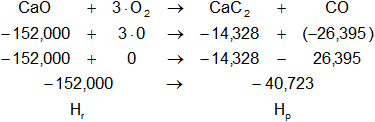
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = -40,723 kcal/mol - (-152,0000208 kcal/mol)
ΔH = -40,723 kcal/mol + 152,0000208 kcal/mol
ΔH = 111,2770208 kcal/mol
Calculamos el mol del carburo de calcio:
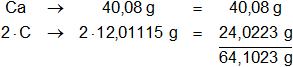
Calculamos el número de moles del carburo de calcio en 1 kg:
1 kg = 1.000 g
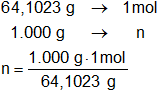
n = 15,60006427 moles
Calculamos el calor necesario para 1 kg de carburo de calcio:
Q = 15,60006427 moles·111,2770208 kcal/mol
Q = 1.735,928677 kcal
Respuesta: la cantidad de calor necesaria para obtener 1 kg de carburo de calcio es 1.735,9 kcal.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP08
- | Siguiente ›
Ejemplo, cómo calcular el calor de formación de un compuesto