Problema nº 1 de compuestos químicos, formación de los óxidos, hidróxidos y ácidos. Fórmula desarrollada - TP06
Enunciado del ejercicio nº 1
Dados los siguientes elementos: Cr, Au, Cu, F, I, Si, B, Mg, Li, Na, Zn y C;
a) Clasificarlos en metales, no metales y anfóteros.
b) La ecuación química correspondiente a la formación de los óxidos, hidróxidos y ácidos.
c) Nombrar los compuestos obtenidos.
d) Dibujar la fórmula desarrollada.
Solución
a)
Clasificarlos en metales, no metales y anfóteros.
Cr: anfótero
Au: metal
Cu: metal
F: no metal
I: no metal
Si: no metal
B: no metal
Mg: metal
Li: metal
Na: metal
Zn: metal
C: no metal
b) La ecuación química correspondiente a la formación de los óxidos, hidróxidos y ácidos.
Cromo
Valencia II (metal).
Ecuación de formación del óxido:
2·Cr + O₂ ⟶ 2·CrO (óxido cromoso)
Fórmula desarrollada:
Cr = O
Ecuación de formación del hidróxido:
CrO + H₂O ⟶ Cr(OH)₂ (hidróxido cromoso)
Fórmula desarrollada:
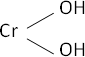
Valencia III (metal).
Ecuación de formación del óxido:
4·Cr + 3·O₂ ⟶ 2·Cr₂O₃ (óxido crómico)
Fórmula desarrollada:
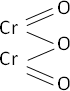
Ecuación de formación del hidróxido:
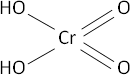
Cr₂O₃ + 3·H₂O ⟶ 2·Cr(OH)₃ (hidróxido crómico)
Fórmula desarrollada:
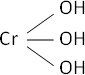
Valencia VI (no metal).
Ecuación de formación del anhídrido:
2·Cr + 3·O₂ ⟶ 2·CrO₃ (anhídrido crómico)
Fórmula desarrollada:
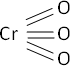
Ecuación de formación de ácido:
CrO₃ + H₂O ⟶ H₂CrO₄ (ácido crómico)
Fórmula desarrollada:
Oro
Valencia I.
Ecuación de formación del óxido:
4·Au + O₂ ⟶ 2·Au₂O (óxido auroso)
Fórmula desarrollada:
![]()
Ecuación de formación del hidróxido:
Au₂O + H₂O ⟶ 2·AuOH (hidróxido auroso)
Fórmula desarrollada:
Au - OH
Valencia III.
Ecuación de formación del óxido:
4·Au + 3·O₂ ⟶ 2·Au₂O₃ (óxido áurico)
Fórmula desarrollada:
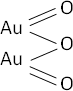
Ecuación de formación del hidróxido:
Au₂O₃ + 3·H₂O ⟶ 2·Au(OH)₃ (hidróxido áurico)
Fórmula desarrollada:
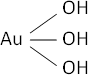
Cobre
Valencia I.
Ecuación de formación del óxido:
4·Cu + O₂ ⟶ 2·Cu₂O (óxido cuproso)
Fórmula desarrollada:
![]()
Ecuación de formación del hidróxido:
Cu₂O + H₂O ⟶ 2·CuOH (hidróxido cuproso)
Fórmula desarrollada:
Cu - OH
Valencia II.
Ecuación de formación del óxido:
2·Cu + O₂ ⟶ 2·CuO (óxido cúprico)
Fórmula desarrollada:
Cu = O
Ecuación de formación del hidróxido:
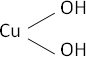
CuO + H₂O ⟶ Cu(OH)₂ (hidróxido cúprico)
Fórmula desarrollada:
Flúor
Valencia I.
Ecuación de formación del óxido:
2·F₂ + O₂ ⟶ 2·F₂O (óxido de flúor)
Fórmula desarrollada:
![]()
Ecuación de formación de ácido:
F₂O + H₂O ⟶ 2·HFO (ácido de flúor)
Fórmula desarrollada:
F - OH
Yodo
Valencia I.
Ecuación de formación del óxido:
2·I₂ + O₂ ⟶ 2·I₂O (óxido hipoyodoso)
Fórmula desarrollada:
![]()
Ecuación de formación de ácido:
I₂O + H₂O ⟶ 2·HIO (ácido hipoyodoso)
Fórmula desarrollada:
I - OH
Valencia III.
Ecuación de formación del óxido:
2·I₂ + 3·O₂ ⟶ 2·I₂O₃ (óxido yodoso)
Fórmula desarrollada:
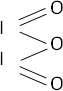
Ecuación de formación de ácido:
I₂O₃ + H₂O ⟶ 2·HIO₂ (ácido yodoso)
Fórmula desarrollada:
HO - I = O
Valencia V.
Ecuación de formación del óxido:
2·I₂ + 5·O₂ ⟶ 2·I₂O₅ (óxido yódico)
Fórmula desarrollada:
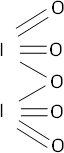
Ecuación de formación de ácido:
I₂O₅ + H₂O ⟶ 2·HIO₃ (ácido yódico)
Fórmula desarrollada:
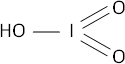
Valencia VII.
Ecuación de formación del óxido:
2·I₂ + 7·O₂ ⟶ 2·I₂O₇ (óxido peryódico)
Fórmula desarrollada:
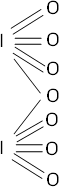
Ecuación de formación de ácido:
I₂O₇ + H₂O ⟶ 2·HIO₄ (ácido peryódico)
Fórmula desarrollada:
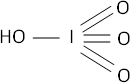
Silicio
Valencia IV.
Ecuación de formación del óxido:
Si + O₂ ⟶ SiO₂ (óxido de silicio)
Fórmula desarrollada:
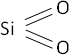
Ecuación de formación de ácido:
SiO₂ + H₂O ⟶ H₂SiO₃ (ácido de silicio)
Fórmula desarrollada:
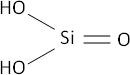
Boro
Valencia III.
Ecuación de formación del óxido:
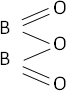
2·B₂ + 3·O₂ ⟶ 2·B₂O₃ (trióxido de diboro)
Fórmula desarrollada:
Ecuación de formación de ácido:
B₂O₃ + H₂O ⟶ 2·HBO₂ (ácido metabórico)
Fórmula desarrollada:
HO - B = O
Magnesio
Valencia II.
Ecuación de formación del óxido:
2·Mg + O₂ ⟶ 2·MgO (óxido de magnesio)
Fórmula desarrollada:
Mg = O
Ecuación de formación del hidróxido:
MgO + H₂O ⟶ Mg(OH)₂ (hidróxido de magnesio)
Fórmula desarrollada:
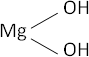
Litio
Valencia I.
Ecuación de formación del óxido:
4·Li + O₂ ⟶ 2·Li₂O (óxido de litio)
Fórmula desarrollada:
![]()
Ecuación de formación del hidróxido:
Li₂O + H₂O ⟶ 2·LiOH (hidróxido de litio)
Fórmula desarrollada:
Li - OH
Sodio
Valencia I.
Ecuación de formación del óxido:
4·Na + O₂ ⟶ 2·Na₂O (óxido de sodio)
Fórmula desarrollada:
![]()
Ecuación de formación del hidróxido:
Na₂O + H₂O ⟶ 2·NaOH (hidróxido de sodio)
Fórmula desarrollada:
Na - OH
Cinc
Valencia II.
Ecuación de formación del óxido:
2·Zn + O₂ ⟶ 2·ZnO (óxido de cinc)
Fórmula desarrollada:
Zn = O
Ecuación de formación del hidróxido:
ZnO + H₂O ⟶ Zn(OH)₂ (hidróxido de cinc)
Fórmula desarrollada:
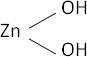
Carbono
Valencia IV.
Ecuación de formación del óxido:
C + O₂ ⟶ CO₂ (óxido carbónico)
Fórmula desarrollada:
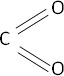
Ecuación de formación de ácido:
CO₂ + H₂O ⟶ H₂CO₃ (ácido carbónico)
Fórmula desarrollada:
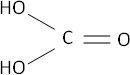
c)
Nombrar los compuestos obtenidos.
Los nombres de los compuestos se dan en el ítem (b).
d)
Dibujar la fórmula desarrollada.
Las fórmulas desarrolladas se dan en el ítem (b).
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, formación de los óxidos, hidróxidos y ácidos. Fórmula desarrollada