Problema nº 7 de electrólisis. Leyes de Faraday y equivalente electroquímico, masa que se deposita en el cátodo y la carga - TP02
Enunciado del ejercicio nº 7
¿Durante cuánto tiempo deberá circular una corriente de 2 A por una solución de cloruro cúprico para conseguir un depósito de 70 g de cobre?
¿Qué cantidad de corriente circuló durante ese tiempo?
Siendo F = 96.500 C y P.A. del cobre 63,5; hallar su equivalente electroquímico.
Desarrollo
Datos:
i = 2 A
m Cu = 70 g
P.A. Cu = 63,5 g
F = 96.500 C
ζCu²⁺ = 0,000329 g/C *
Fórmulas:
m = ζ·i·t
![]()
Solución
a) Cálculo del tiempo empleado.
Aplicamos la primera ley de Faraday:
m = ζ·i·t
Despejamos t:
![]()
Reemplazamos por los datos y calculamos:
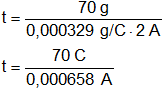
Recordemos que C/s = A.
t = 106.382,9787 s
Respuesta a): el tiempo requerido es de 106.383 s (29 h 33 min 2 s).
b) Cálculo de la carga.
Aplicamos la fórmula de carga eléctrica:
q = i·t
Reemplazamos por los datos y calculamos:
q = 2 A·106.382,9787 s
q = 212.765,9574 C
Respuesta b): carga total es 212.766 C.
c) Cálculo del equivalente electroquímico.
Hallamos el equivalente químico del cobre bivalente:
![]()
Reemplazamos por los datos y calculamos:
![]()
Eq = 31,75 g
Aplicamos la fórmula del equivalente electroquímico:
![]()
Reemplazamos por los datos y calculamos:
![]()
ζ = 0,000329016 g/C
Respuesta c): el equivalente electroquímico es 0,000329 g/C.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo, cómo calcular la masa que se deposita en el cátodo y la carga