Problema nº 6, constante de equilibrio químico (ejercicio modelo) - TP01
Enunciado del ejercicio nº 6
Al mezclar los reactivos A y B, cada uno a la concentración de 0,8 moles/l, reaccionan dando en el equilibrio:
A + B ⇌ C + D
La concentración de C y D es 0,6 moles/l.
Calcular el valor de la constante de equilibrio.
Solución
Expresamos la ecuación de la reacción:
A + B ⇌ C + D
Aplicamos la fórmula de la constante de equilibrio:
![]()
Si se forman 0,6 moles/l de C y 0,6 moles/l de D, desaparecen 0,6 moles/l de A y de B.
Reemplazamos por los datos y calculamos:
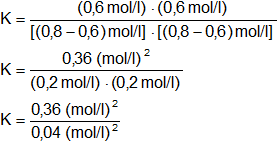
Simplificamos las unidades:
![]()
K = 9
Respuesta: el valor de la constante de equilibrio K es 9
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular la constante de equilibrio