Problema nº 9 de estequiometria de las reacciones químicas, reactivos y productos - TP02
Enunciado del ejercicio nº 9
Una aleación tiene 20 % de cobre y 80 % de plata. Calcular la masa de sulfato cúprico y sulfato de plata que se podrán obtener con 5 g de dicha aleación.
Desarrollo
Datos:
maleación = 5 g
Solución
La ecuación estequiométrica balanceada es la siguiente:
Cu + 2·Ag + 2·H₂SO₄ ⟶ CuSO₄ + Ag₂SO₄ + 2·H₂
Calculamos el mol de cada compuesto que interviene en la reacción:
Cu: 63,5 g
2·Ag: 2·107,87 = 215,74 g
2·H₂SO₄: 2·(2·1 g + 32,06 g + 4·16 g) = 196,12 g
CuSO₄: 63,5 g + 32,06 g + 4·16 g = 159,56 g
Ag₂SO₄: 2·107,87 g + 32,06 g + 4·16 g = 311,8 g
2·H₂: 2·2·1 g = 4 g
![]()
La masa de cobre en la aleación es:
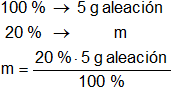
mCu = 1 g de Cu
La masa de plata en la aleación es:
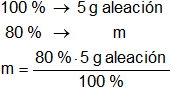
mAg = 4 g de Ag
Mediante regla de tres simple calculamos que masa de sulfato cúprico obtenido:
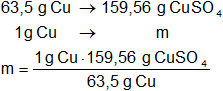
msulfato cúprico = 2,51 g de CuSO₄
Con el mismo método calculamos la masa de sulfato de plata formado:
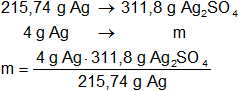
msulfato de plata = 5,78 g de Ag₂SO₄
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo de cómo determinar las cantidades de las sustancias reaccionantes y de los productos de reacción