Problema nº 10 de estequiometria de las reacciones químicas, reactivos y productos - TP02
Enunciado del ejercicio nº 10
Se necesitan 20 litros de oxígeno en CNPT. Calcular qué cantidad de clorato de potasio de 95 % de pureza deben descomponerse para obtener ese volumen.
KClO₃ ⟶ KCl + 3/2·O₂
Desarrollo
Datos:
VO₂ = 20 l = 20 dm³
Solución
La ecuación estequiométrica balanceada es la siguiente:
KClO₃ ⟶ KCl + 3/2·O₂
Calculamos el mol de cada compuesto que interviene en la reacción:
KClO₃: 39,1 g + 35,5 g + 3·16 g = 122,6 g
kCl: 39,1 g + 35,5 g = 74,6 g
3/2·O₂: 3/2·(2·16 g) = 48 g
![]()
Según la ecuación estequiométrica se obtiene 3/2 mol de oxígeno que (en CNPT) equivale a (3/2)·22,4 dm³ = 33,6 dm³. Entonces:
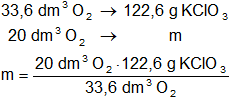
mclorato de potasio = 72,98 g de KClO₃ al 95 %
Mediante regla de tres simple calculamos que masa de clorato de potasio de 95 % necesaria:
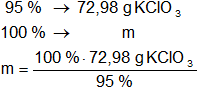
mclorato de potasio = 76,82 g de KClO₃
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo de cómo determinar las cantidades de las sustancias reaccionantes y de los productos de reacción