Problema nº 6 de gases ideales, temperatura final de un gas - TP02
Enunciado del ejercicio nº 6
¿A qué temperatura 0,1 g de hidrógeno ocupa un volumen de 1 litro a presión normal?
Desarrollo
Datos:
m = 0,1 g
V = 1 l = 1 dm³
p = 1 atm
R = 0,08205 atm·dm³/K·mol
Fórmulas:
p·V·mol = m·R·T
Solución
Calculamos la masa de un mol de hidrógeno:
Mol de H₂: 2·1,00797 g = 2,01594 g
Aplicamos la fórmula dada despejando "T":
p·V·mol = m·R·T
![]()
Reemplazamos por los datos y calculamos:
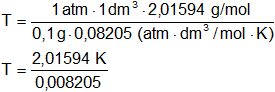
T = 245,6965265 K
Resultado, la temperatura de 0,1 g de hidrógeno a presión normal es:
T = 245,7 K
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo de cómo determinar la temperatura final de un gas