Problema nº 10 de gases ideales, volumen de la masa de un gas - TP02
Enunciado del ejercicio nº 10
En siguiente ecuación de descomposición:
CaCO₃ ⟶ CaO + CO₂
Calcular:
a) Los litros de anhídrido carbónico a 2 atmósferas y 47 °C que se obtienen con 200 g de CaCO₃
b) Los moles de CaO que se obtienen por descomposición de 150 g de CaCO₃
Desarrollo
Datos:
mₐ = 200 g de CaCO₃
pₐ = 2 atm
Tₐ = 47 °C = 320 K
mb = 150 g de CaCO₃
Fórmulas:
![]()
Solución
Calculamos las masas de los moles que intervienen en la reacción en equilibrio:
CaCO₃: 40,08 g + 12,01115 + 3·15,9994 g = 100,08935 g ≅ 100 g
CaO: 40,08 g + 15,9994 g = 56,0794 g ≅ 56 g
CO₂: 12,01115 g + 2·15,9994 g = 44,00995 g ≅ 44 g
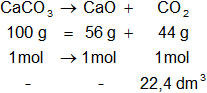
a)
Mediante regla de tres simple calculamos el volumen de dióxido de carbono que se obtienen a partir de 200 g de CaCO₃ en CNPT:
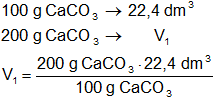
V₁ = 44,8 dm³ de CO₂
De la ecuación general de los gases ideales despejamos Vₐ:
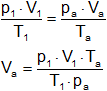
Reemplazamos por los datos y calculamos:

Vₐ = 26,26 dm³ de CO₂
b)
Calculamos los moles de dióxido de carbono que se obtienen a partir de 150 g de CaCO₃ en CNPT:
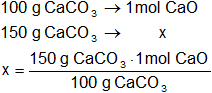
mol = 1,5 mol de CaO
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo de cómo determinar el volumen de la masa de un gas