Problema nº 3 de ecuación de estado de los gases ideales, concentración - TP17
Enunciado del ejercicio nº 3
¿Cuál es la concentración en moles/l y en moléculas/cm³ de un gas ideal a 25 °C y 1 atmósfera de presión?
Desarrollo
Datos:
t = 25 °C
p = 1 atm
Presión constante.
Fórmulas:
p·V = n·R·T
Solución
a)
Aplicamos la ecuación de estado de los gases ideales:
p·V = n·R·T
Suponemos:
V = 1 l
n es el número de moles y C es la concentración, luego:
![]()
Reemplazamos:
![]()
Convertimos las unidades de temperatura:
T = 273 °C + 25 °C = 298 K
Reemplazamos por los datos y calculamos:
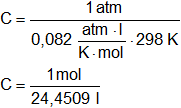
C = 0,04089829 mol/l
Resultado a), la concentración en moles/l es:
C = 0,0409 mol/l
b)
Con el dato anterior, adecuamos las unidades de volumen:
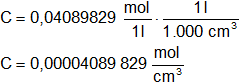
Calculamos la concentración en moléculas/cm³:
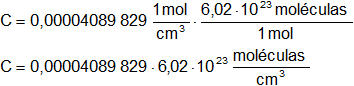
C = 2,46208·10¹⁹ moléculas/cm³
Resultado b), la concentración en moléculas/cm³ es:
C = 2,46·10¹⁹ moléculas/cm³
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP17
- | Siguiente ›
Ejemplo de cómo determinar la concentración de un gas