Guía nº 9 de ejercicios resueltos de gases ideales (química)
Resolver los siguientes ejercicios
Problema nº 1
¿Hasta qué temperatura deben enfriarse 280 cm³ de CO₂ para que su volumen disminuya hasta 130 cm³? La Tᵢ = -20 °C y el gas se mantiene a presión constante.
V₁ = 280 cm³
V₂ = 130 cm³
Convertimos las unidades de temperatura:
T₁ = -20 °C = 253 K
T₂ = ?
![]()
Reemplazamos por los datos y resolvemos:
![]()
T₂ = 117,46 K = -155,5 °C
Problema nº 2
¿Cuál es volumen de 600 cm³ CNPT de N₂ a 45 °C y a 2 atm de presión?
V₁ = 600 cm³
V₂ = ?
p₁ = 1 atm
p₂ = 2 atm
T₁ = 273 K
Convertimos las unidades de temperatura:
T₂ = 45 °C = 318 K
![]()

V₂ = 349 cm³
Problema nº 3
Se recolectaron por desplazamiento de mercurio 720 cm³ de gas nitrógeno a -10 °C y 25 cm de Hg de presión. ¿Cuál es volumen a CNPT?
V₁ = 720 cm³
V₂ = ?
p₁ = 25 cm de Hg
Convertimos las unidades de presión:
p₂ = 1 atm = 76 cm de Hg
Convertimos las unidades de temperatura:
T₁ = -10 °C = 263 K
T₂ = 273 K
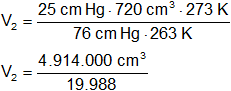
V₂ = 245,84 cm³
Problema nº 4
¿Cuál es la información que falta en los siguientes problemas para poder resolverlos?
a)
Un volumen de gas es comprimido desde 10 atmósferas hasta 1 atmósfera a temperatura constante. ¿Cuál es el volumen final?
Respuesta: Volumen inicial
b)
¿Qué volumen ocuparan 15 cm³ de gas cuando se enfríen a -30 °C y presión constante?
Respuesta: Temperatura inicial
c)
80 cm³ de gas a -38 se calientan a 40 °C y a 80 mm Hg de presión. ¿Cuál fue la presión inicial?
Respuesta: Volumen final
Problema nº 5
Usando factores de conversión conviértase el valor de R desde 82 cm³·atm/K·mol hasta unidades de:
a) cm³·mm Hg/mol·K
b) 1 lb/pulg²/mol·K
c) Ergios/mol·K
Problema nº 6
Se a encontrado que 820 cm³ de un gas desconocido a 35 °C y a 80 cm de Hg pesan 2,46 g. ¿Cuál es su peso molecular?
V = 820 cm³ = 0,82 l
Convertimos las unidades de temperatura:
T = 35 °C = 308 K
Convertimos las unidades de presión:
p = 80 cm de Hg = 1,05 atm
m = 2,46 g
R = 0,082 l·atm/K·mol
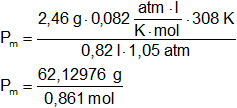
Pₘ = 72,16 g/mol
Problema nº 7
¿Qué volumen ocupar 1,5 g de NO gaseoso a 75 °C y a 300 mm Hg de presión?
M = 1,5 g de NO
Convertimos las unidades de temperatura:
T = 75 °C = 348 K
Convertimos las unidades de presión:
p = 300 mm Hg = 0,39 atmósferas
R = 0,082 l·atm/K·mol
PM = 30 g/mol
![]()
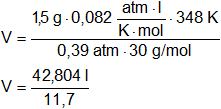
V = 3,65 l
Problema nº 8
Por desplazamiento de agua se han recogido 1,47 l de un gas a 30 °C y la presión barométrica de 744 mm Hg. Si el gas tiene un peso de 1,98 g y la presión del vapor del agua a 30 °C es 32 mm Hg, ¿Cuál es peso molecular del gas?
V = 1,47 l
Convertimos las unidades de temperatura:
T = 30 °C = 303 K
M = 1,98 g
p = 0,93 atmósferas
R = 0,082 l·atm/K·mol
![]()
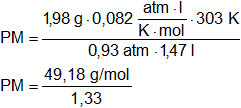
PM = 35,9 g/mol
Problema nº 9
Por desplazamiento de acetona se recogen 250 cm³ de un gas a -10 °C y a 85 cm de Hg de presión. Si el gas pesa 1,34 g y la presión del vapor de la acetona - 10 °C es 39 mm Hg. ¿Cuál es el peso molecular del gas?
V = 250 cm³
Convertimos las unidades de temperatura:
T = -10 °C = 263 K
M = 1,34 g
p = 1,06 atmósferas
R = 0,082 l·atm/K·mol
![]()
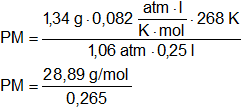
PM = 100,01 g/mol
Bibliografía:
Cálculos Químicos de Benson.
Autor: Carlos Alberto Lozano Escobedo. México.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
Problemas resuelto.