Guía nº 10 de ejercicios resueltos de gases ideales (química)
Resolver los siguientes ejercicios
Problema nº 1
Se a encontrado la densidad de un gas es 2,07 g/l a 30 °C y a 2 atmósferas de presión. ¿Cuál es su densidad a CNPT?
δ = 2,07 g/l
p = 2 atm
Convertimos las unidades de temperatura:
T = 30 °C = 303 K
R = 0,082 l·atm/K·mol
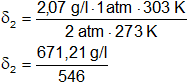
δ₂ = 1,14 g/l
Problema nº 2
La densidad del cloro gaseoso es 3,17 mg/cm³ a CNPT. ¿Cuál es su densidad a 100 °C y a 70 cm de Hg?
δ = 3,17 g/cm³
p = 70 cm de Hg = 0,92 atm.
Convertimos las unidades de temperatura:
T = 100 °C = 373 K
R = 0,082 l·atm/K·mol
δ₂ = ¿?
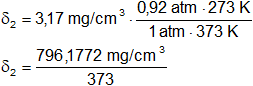
δ₂ = 2,13 mg/cm³
Problema nº 3
La presión de la atmósfera a 100 millas arriba de la tierra es de unos 2·10⁻⁶ mm Hg y la temperatura es cercana a -180 °C. ¿Cuántas moléculas habrá en 1 cm³ de un gas a esa altitud?
Convertimos las unidades de presión:
p = 2·10⁻⁶ mm Hg
![]()
p = 2,63·10⁻⁹ atm
V = 1 cm³ = 0,001 l = 10⁻³ l
Convertimos las unidades de temperatura:
T = -180 °C = 93 K
p·V = n·R·T
![]()
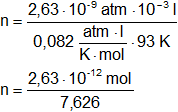
n = 3,448·10⁻¹³ mol
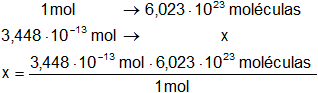
x = 2,07·10¹¹ moléculas
Problema nº 4
¿Cuál es la densidad del SO₂ gaseoso a CNPT, a 40 °C y a 80 cm de Hg de presión?
p = 80 cm de Hg
Convertimos las unidades de temperatura:
T = 40 °C = 313 K
PM = 64 g/mol
R = 0,082 l·atm/K·mol
![]()
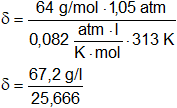
δ = 2,6 g/l
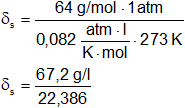
δₛ = 2,8 g/l
Problema nº 5
Se ha encontrado que un gas desconocido tiene una densidad 2,5 veces más grande que la del oxígeno (O₂) a la misma T y P. ¿Cuál es su peso molecular?
Respuesta: 2,5·32 g/mol = 80 mol
Problema nº 6
A una determinada T y P el CO₂ tiene una densidad que es 0,758 la de un gas X. ¿Cuál es el peso molecular de X? ¿Cuál es la densidad de X a CNPT?
PMX = 44 (g/mol)·0,758 = 33,352 g/mol
![]()
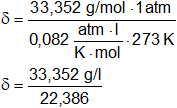
δ = 1,49 g/l
Problema nº 7
La composición del aire seco es aproximadamente 78 mol por ciento de N₂, 21 mol por ciento de O₂ y 1 mol por ciento de Ar. Cuando la presión barométrica es 750 mm Hg calcúlese la presión parcial ejercida por estos 3 componentes en el aire seco.
Problema nº 8
Un matraz de 1.500 cm³ contiene 400 mm de O₂ y 60 mm de H₂, a 100 °C.
¿Cuál es la presión total dentro del matraz?
Si se permite que la mezcla reaccione para formar H₂O (gaseosa) a la misma temperatura ¿Qué materiales sobraran y cuáles serán sus presiones parciales?
Problema nº 9
¿Cuál tendrá el valor de Cᵥ más grande, Hₑ ó HCl? Explíquese.
Respuesta: HCl tiene 2° rotacionales de libertad extra.
Bibliografía:
Cálculos Químicos de Benson.
Autor: Carlos Alberto Lozano Escobedo. México.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
Problemas resuelto.