Problema nº 3 de ley de las proporciones múltiples - TP02
Enunciado del ejercicio nº 3
Al analizar dos sustancias que contienen cloro (Cl) y mercurio (Hg) se obtienen los siguientes resultados:
Muestra I: 100 g contienen ⟶ Cl: 10,54 %; Hg: 89,46 %
Muestra II: 100 g contienen ⟶ Cl: 26,11 %; Hg: 73,89 %
Indicar:
a) ¿Las muestras corresponden a un mismo compuesto?
b) ¿Qué leyes se cumplen?
c) ¿Qué masa de mercurio se combina con 1 g de cloro?
Desarrollo
Datos:
m₁ = 100 g
m₂ = 100 g
m1Cl = 10,54 %
m1Hg = 89,46 %
m2Cl = 26,11 %
m2Hg = 73,89 %
Solución
a)
Verificamos por la ley de las proporciones definidas.
Realizamos las relaciones correspondientes entre las masas de mercurio y las de cloro:
![]()
![]()
R₁ = 8,49
![]()
![]()
R₂ = 2,83
R₁ ≠ R₂
No se cumple la ley de las proporciones definidas, por lo tanto, no es la misma sustancia.
Verificamos por la ley de las proporciones múltiples haciendo el cociente entre R₁ y R₂.
![]()
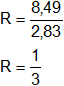
b)
Se cumple la ley de las proporciones múltiples o ley de Dalton.
c)
En la muestra I se combinan 8,49 g de mercurio por cada gramo de cloro.
En la muestra II se combinan 2,83 g de mercurio por cada gramo de cloro.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo, cómo verificar la ley de las proporciones múltiples