Problema nº 2 de número de Avogadro, masa de un átomo - TP03
Enunciado del ejercicio nº 2
Calcular la masa de un átomo de yodo sabiendo que su mol es de 254 g. Idem para helio, cloro, hidrógeno, calcio; sabiendo que sus pesos atómicos son: 4; 35,5; 1 y 40 respectivamente. Dato NA = 6,02·10²³
Desarrollo
Datos:
Mol I = 254 g
Masa atómica He = 4 g
Masa atómica Cl = 35,5 g
Masa atómica H = 1 g
Masa atómica Ca = 40 g
NA = 6,02·10²³ (número de Avogadro)
Solución
a) Yodo, molécula biatómica (I₂)
Calculamos la masa de un átomo de yodo:
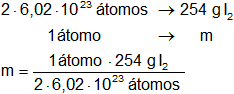
m = 2,11·10⁻22 g de I
Respuesta a): la masa de un átomo de yodo es 2,11·10⁻22 g
b) Helio
Calculamos la masa de un átomo de helio:
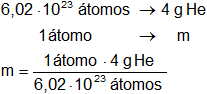
m = 6,64·10⁻²⁴ g de He
Respuesta b): la masa de un átomo de helio es 6,64·10⁻²⁴ g
c) Cloro
Calculamos la masa de un átomo de cloro:
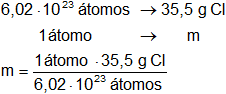
m = 5,9·10⁻²³ g de Cl
Respuesta c): la masa de un átomo de cloro es 5,9·10⁻²³ g
d) Hidrógeno
Calculamos la masa de un átomo de hidrógeno:

m = 1,66·10⁻²⁴ g de H
Respuesta d): la masa de un átomo de hidrógeno es 1,66·10⁻²⁴ g
e) Calcio
Calculamos la masa de un átomo de calcio:
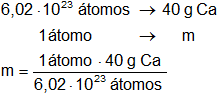
m = 6,64·10⁻²³ g de Ca
Respuesta e): la masa de un átomo de calcio es 6,64·10⁻²³ g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo calcular la masa de un átomo con el número de Avogadro