Problema nº 3 de ley de Lavoisier y Proust - TP03
Enunciado del ejercicio nº 3
Se analizaron dos muestras de metano con los siguientes resultados:
Muestra I: 16 g de muestra, 12 g de C, 4 g de H.
Muestra II: 50 g de muestra, 37,5 g de C, 12,5 g de H.
a) ¿Qué leyes gravimétricas se cumplen y por qué?
b) ¿Es este compuesto definido?
c) ¿Cuántos gramos de H se combinan con 96 g de C?
d) ¿Cuántos gramos de H se necesitan para obtener 80 g de muestra?
Solución
a)
Observamos que:
12 g de C + 4 g de H = 16 g
37,5 g de C + 12,5 g de H = 50 g
La suma de las masas de las sustancias reaccionantes es igual a la masa del compuesto producto de la reacción. Se cumple la ley de Lavoisier.
Luego, efectuamos la relación entre los mismos elementos de las distintas muestras:
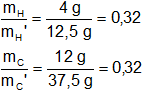
Existe una relación constante de masas. Se cumple la ley de Proust.
b)
Sí, es un compuesto definido porque se cumple la ley de Proust.
c)
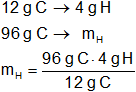
mH = 32 g de H
d)

mH = 20 g de H
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, aplicación de las leyes gravimétricas o ponderales