Problema nº 1 de ecuaciones de óxido reducción, número de oxidación - TP03
Enunciado del ejercicio nº 1
Determine el número de oxidación del átomo indicado en los siguientes compuestos:
a) Cl en el KClO₂
b) Mn en el K₂MnO₄
c) S en el H₂SO₄
d) S en el H₂S
e) Cr en el K₂Cr₂O₇
f) Cr en el K₂CrO₄
Solución
a)
Cl en el KClO₂
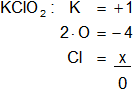
Armamos la ecuación, luego despejamos "x" y calculamos:
1 - 4 + x = 0
x = -1 + 4
Resultado a): el número de oxidación del "Cl" es +3
b)
Mn en el K₂MnO₄
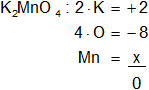
Armamos la ecuación, luego despejamos "x" y calculamos:
2 - 8 + x = 0
x = -2 + 8
Resultado b): el número de oxidación del "Mn" es +6
c)
S en el H₂SO₄
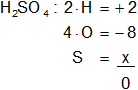
Armamos la ecuación, luego despejamos "x" y calculamos:
2 - 8 + x = 0
x = -2 + 8
Resultado c): el número de oxidación del "S" es +6
d)
S en el H₂S
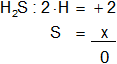
Armamos la ecuación, luego despejamos "x" y calculamos:
2 + x = 0
Resultado d): el número de oxidación del "S" es -2
e)
Cr en el K₂Cr₂O₇
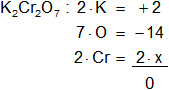
Armamos la ecuación, luego despejamos "x" y calculamos:
2 - 14 + 2·x = 0
2·x = -2 + 14
2·x = 12
x = 12/2
Resultado e): el número de oxidación del "Cr" es +6
f)
Cr en el K₂CrO₄
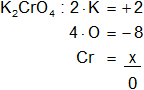
Armamos la ecuación, luego despejamos "x" y calculamos:
2 - 8 + x = 0
x = -2 + 8
Resultado f): el número de oxidación del "Cr" es +6
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo determinar el número de oxidación