Problema nº 3 de estequiometría de las disoluciones, normalidad - TP01
Enunciado del ejercicio nº 3
Hallar la normalidad de una solución de H₂SO₄ de 98 % P/P y densidad 1,84 g/cm³
Desarrollo
Datos:
C = 98 % P/P
δ = 1,84 g/cm³
Fórmulas:
![]()
Solución
1.000 cm³ de la solución ácida pesa 1.840 g:
![]()
![]()
Como su concentración es de 98 % P/P, aplicamos regla de tres simple:

x = 1.803,2 g de ácido
El equivalente gramo del ácido sulfúrico es igual a su mol dividido la cantidad de iones hidrógeno que posee en su molécula.
Calculamos el mol del ácido sulfúrico:
H₂SO₄: 2·1 g + 32 g + 4·16 g = 98 g
Tiene 2 hidrógenos:
![]()
El equivalente gramo del ácido sulfúrico es Eg = 49 g, entonces:
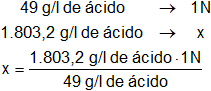
Resultado, la normalidad de una solución de H₂SO₄ es:
x = 36,8 N
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular la normalidad de una solución