Problema nº 8 de estequiometría de las disoluciones, molaridad - TP02
Enunciado del ejercicio nº 8
¿Qué cantidad de CaCl₂ se necesitan para preparar:
a) 400 cm³ de solución 0,5 M.
b) 3.000 cm³ de solución 3 M.
Solución
Molaridad (M): es el número de moles que tiene una solución por 1.000 cm³ de solución (sc).
Calculamos el mol de CaCl₂
40 g + 2·35,5 = 111 g
a)
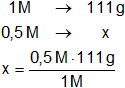
x = 55,5 g de CaCl₂
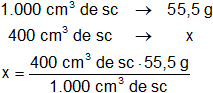
Resultado, para preparar 400 cm³ de solución 0,5 M se necesitan:
x = 22,2 g de CaCl₂
b)
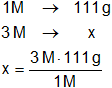
x = 333 g de CaCl₂
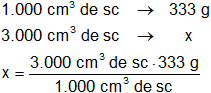
Resultado, para preparar 3.000 cm³ de solución 3 M se necesitan:
x = 999 g de CaCl₂
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo, cómo calcular la molaridad de una solución