Problema nº 5 de estequiometría de las disoluciones, masa y molaridad - TP03
Enunciado del ejercicio nº 5
¿Qué masa de hidróxido de bario se necesitan para preparar 1,5 litros de solución 3 M?
Solución
Calculamos el mol del hidróxido de bario:
Ba(OH)₂: 137,3 g + 2·(16 g + 1 g) = 171,3 g
Calculamos la masa de hidróxido de bario referida a 1 litro de solución 3 M:
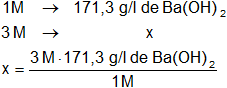
x = 513,9 g de Ba(OH)₂/l de solución
Calculamos la masa de hidróxido de bario referida a 1,5 litro:
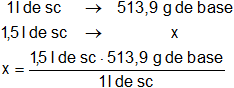
Resultado, la masa de hidróxido de bario necesaria para preparar 1,5 litros de solución 3 M es:
x = 770,85 g de Ba(OH)₂
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo calcular la masa de soluto de una solución