Problema nº 2 de moles y fórmula gramo - TP04
Enunciado del ejercicio nº 2
Calcular:
a) La masa de S en 0,1 fórmula gramo de Na₂S₂O₃
b) La masa de Cl en 0,5 moles de Cl₂CH₂
c) La masa de C en 5 moles de CH₃—CH₂OH
Datos:
mS = 32,064 g
mCl = 35,453 g
mC = 12,01115 g
Solución
a) La masa de S en 0,1 fórmula gramo de Na₂S₂O₃
La fórmula gramo o peso fórmula son equivalentes al mol de una sustancia o ion.
La fórmula del Na₂S₂O₃ nos indica que hay 2 átomos de azufre en la molécula.
Calculamos masa de S en 0,1 fórmula gramo de Na₂S₂O₃:

x = 6,41 g de S
Respuesta a): en 0,1 fórmula gramo de Na₂S₂O₃ hay 6,41 g de S
b) La masa de Cl en 0,5 moles de Cl₂CH₂
La fórmula del Cl₂CH₂ nos indica que hay 2 átomos de cloro en la molécula.
Calculamos masa de Cl en 0,5 moles de Cl₂CH₂:
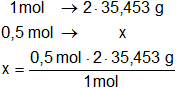
x = 35,45 g de Cl
Respuesta b): en 0,5 moles de Cl₂CH₂ hay 35,45 g de Cl
c) La masa de C en 5 moles de CH₃—CH₂OH
La fórmula del CH₃—CH₂OH nos indica que hay 2 átomos de carbono en la molécula.
Calculamos masa de C en 5 moles de CH₃—CH₂OH:
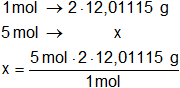
x = 120,11 g de C
Respuesta c): en 5 moles de CH₃—CH₂OH hay 120,11 g de C
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo calcular la masa de un elemento en una sustancia