Problema nº 1 de peso molecular - TP04
Enunciado del ejercicio nº 1
Calcular el peso molecular de cada una de las siguientes sustancias:
a) H₂O
b) D₂O
c) CH₄
d) C₆H₁₂O₂
Desarrollo
Para hallar el valor de una molécula gramo o mol de una sustancia debemos conocer el valor de los pesos atómicos relativos de los átomos que la forman.
El mol es la suma de los pesos atómicos de todos los elementos que forman la molécula.
Solución
a) H₂O
Los pesos atómicos de los elementos presentes en el agua son:
mH = 1,00797 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
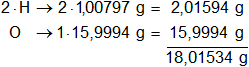
Respuesta a): el peso molecular del H₂O es 18,01534 g
b) D₂O
Los pesos atómicos de los elementos presentes en el agua pesada son:
mD = 2,01410178 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
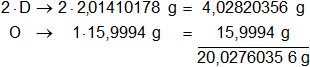
Respuesta b): el peso molecular del D₂O es 20,027604 g
c) CH₄
Los pesos atómicos de los elementos presentes en el metano son:
mH = 1,00797 g
mC = 12,01115 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
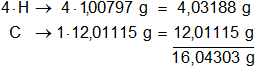
Respuesta c): el peso molecular del CH₄ es 16,04303 g
d) C₆H₁₂O₂
Los pesos atómicos de los elementos presentes en el acetato de butilo o en el ácido hexanoico son:
mH = 1,00797 g
mC = 12,01115 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
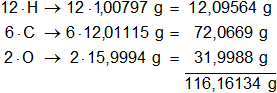
Respuesta d): el peso molecular del C₆H₁₂O₂ es 116,16134 g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo calcular pesos moleculares de una sustancia