Problema nº 4 de teoría atómica - TP04
Enunciado del ejercicio nº 4
Calcular el porcentaje de agua de cristalización existente en el sulfato cúprico pentahidratado (CuSO₄·5·H₂O).
Desarrollo
Datos:
mCu = 63,54 g
mS = 32,064 g
mH = 1,00797 g
mO = 15,9994 g
El mol es la suma de los pesos atómicos de todos los elementos que forman la molécula, en este caso una sal hidratada.
Solución
Calculamos el peso molecular del sulfato cúprico pentahidratado, multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
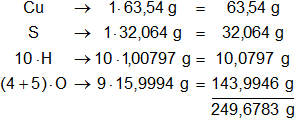
El mol del sulfato cúprico pentahidratado pesa 249,6783 g que equivale al 100 % de la masa.
Calculamos el mol de agua:
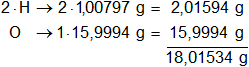
1 mol de agua pesa 18,01534 g, hay 5 moles de agua, por lo tanto, la masa de agua presente en la molécula será:
5 moles de agua = 5·18,01534 g = 90,0767 g
Calculamos el porcentaje de agua contenida en la molécula del sulfato cúprico pentahidratado:
x = 36,08 %
Respuesta: el porcentaje de agua contenida en la molécula del sulfato cúprico pentahidratado es 36,08 %
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo calcular el porcentaje de un compuesto dentro de otro