Problema nº 7 de volumen molar - TP04
Enunciado del ejercicio nº 7
Se tienen 1,806·10²⁴ moléculas de un gas en un recipiente mantenido a presión y temperatura constante, calcular:
a) ¿Cuántos moles de gas hay en el recipiente?
b) Volumen del recipiente.
Desarrollo
Datos:
Moléculas de gas = 1,806·10²⁴ (CNPT)
Volumen molar = 22,4 dm³
1 mol ≡ 6,02·10²³ moléculas (número de Avogadro)
Solución
a)
Calculamos los moles de gas:
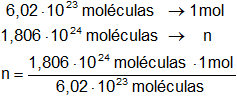
n = 3 moles
Respuesta a): 1,806·10²⁴ moléculas del gas son 3 moles
b)
Calculamos el volumen del gas:
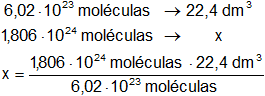
V = 67,2 dm³
Respuesta b): 1,806·10²⁴ moléculas del gas ocupan 67,2 dm³ (volumen del recipiente)
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo calcular la cantidad de moléculas en el volumen de un gas