Problema nº 9 de composición centesimal - TP06
Enunciado del ejercicio nº 9
La fórmula del sulfato de aluminio es Al₂(SO₄)₃·18·H₂O. Calcular la composición centesimal.
Solución
Calculamos el mol del sulfato de aluminio hidratado, este valor será 100 % de la masa.
Los pesos atómicos de los elementos presentes en el sulfato de aluminio son:
mAl = 26,9815 g
mS = 32,064 g
mH = 1,00797 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
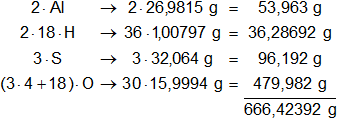
Con estos datos calculamos el porcentaje de cada elemento en el mol:
Porcentaje de aluminio:
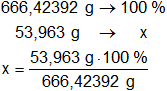
xAl = 8,10 % de Al
Porcentaje de hidrógeno:
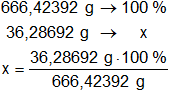
xH = 5,45 % de H
Porcentaje de azufre:
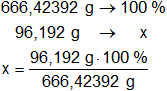
xS = 14,43 % de S
Porcentaje de oxígeno:
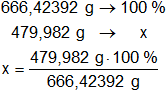
xO = 72,02 % de O
Respuesta, la composición centesimal del sulfato de aluminio es:
S = 14,43 %
O = 72,02 %
Al = 8,10 %
H = 5,45 %
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular la composición centesimal en una sustancia