Problema nº 10 de fórmula molecular - TP06
Enunciado del ejercicio nº 10
Calcular la fórmula molecular de los siguientes compuestos:
a) Compuesto 1: C = 80,0 %; H = 20 %; peso molecular = 30
b) Compuesto 2: C = 92,3 %; H = 7,7 %; peso molecular = 78
Desarrollo
Datos:
Masa atómica C = 12
Masa atómica H = 1
a) Compuesto 1
Datos:
Mol = 30 g
C = 80,0 %
H = 20 %
Solución
La masa de la sustancia equivale al 100 %.
Calculamos la masa de cada elemento que hay en los 30 g de sustancia.
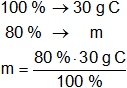
mC = 24 g de C
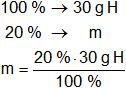
mH = 6 g de H
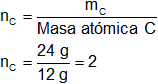
Hay 2 átomos de carbono.
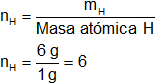
Hay 6 átomos de hidrógeno.
Respuesta a): la fórmula molecular es:
C₂H₆
b) Compuesto 2
Datos:
Mol = 78 g
C = 92,3 %
H = 7,7 %
Solución
La masa de la sustancia equivale al 100 %.
Calculamos la masa de cada elemento que hay en los 78 g de sustancia.
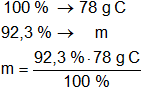
mC = 72 g de C

mH = 6 g de H
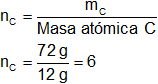
Hay 6 átomos de carbono.
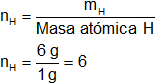
Hay 6 átomos de hidrógeno.
Respuesta b): la fórmula molecular es:
C₂H₆
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular la fórmula molecular de una sustancia