Problema nº 2 a-e de enlace covalente - TP02
Enunciado del ejercicio nº 2 a-e
Empleando sólo los electrones de valencia y utilizando puntos, asteriscos o cualquier otro símbolo, esquematizar las estructuras electrónicas de las siguientes sustancias:
a) H₂S
b) C₂H₆
c) CH₂O
d) HCN
e) C₂H₆O
Solución
a) H₂S
Electrones de valencia del hidrógeno: 1
Electrones de valencia del azufre: 6
Electronegatividad del hidrógeno = 2,20
Electronegatividad del azufre = 2,50
Son no metales.
La diferencia de electronegatividad entre los átomos es: 0,3 < 1,70 ⟶ enlace covalente.
Esquema de la molécula con la distribución de los electrones (estructura de Lewis):
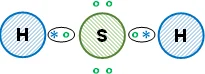
La unión entre los átomos es covalente, todos comparten los electrones de valencia. Así, los átomos de hidrógeno cumplen con la regla del doblete y el átomo de azufre cumple con la regla del octeto. Se obtiene sulfuro de hidrógeno (hidrácido inorgánico).
b) C₂H₆
Electrones de valencia del hidrógeno: 1
Electrones de valencia del carbono: 4
Electronegatividad del hidrógeno = 2,20
Electronegatividad del carbono = 2,56
Son no metales.
La diferencia de electronegatividad entre los átomos es: 0,36 < 1,70 ⟶ enlace covalente.
Esquema de la molécula con la distribución de los electrones (estructura de Lewis):
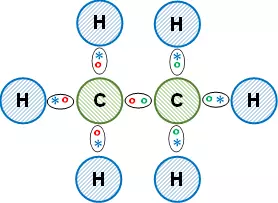
La unión entre los átomos es covalente, todos comparten los electrones de valencia. Así, los átomos de hidrógeno cumplen con la regla del doblete y los átomos de carbono cumplen con la regla del octeto. El compuesto formado es etano (alcano orgánico).
c) CH₂O
Electrones de valencia del hidrógeno: 1
Electrones de valencia del carbono: 4
Electrones de valencia del oxígeno: 6
Electronegatividad del hidrógeno = 2,20
Electronegatividad del carbono = 2,56
Electronegatividad del oxígeno = 3,37
Son no metales. El carbono es el elemento central.
La diferencia de electronegatividad entre carbono y hidrógeno: 0,36 < 1,70 ⟶ enlace covalente.
La diferencia de electronegatividad entre carbono y oxígeno: 0,81 < 1,70 ⟶ enlace covalente.
Esquema de la molécula con la distribución de los electrones (estructura de Lewis):
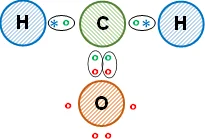
La unión entre los átomos es covalente, todos comparten los electrones de valencia. Así, los átomos de hidrógeno cumplen con la regla del doblete mediante un enlace covalente simple cada uno unidos al carbono, el átomo de carbono y el átomo de oxígeno cumplen con la regla del octeto mediante un enlace covalente doble. Se obtiene metanal (aldehído orgánico).
d) HCN
Electrones de valencia del hidrógeno: 1
Electrones de valencia del carbono: 4
Electrones de valencia del nitrógeno: 5
Electronegatividad del hidrógeno = 2,20
Electronegatividad del carbono = 2,56
Electronegatividad del nitrógeno = 2,81
Son no metales. El carbono es el elemento central.
La diferencia de electronegatividad entre carbono y hidrógeno: 0,36 < 1,70 ⟶ enlace covalente.
La diferencia de electronegatividad entre carbono y nitrógeno: 0,25 < 1,70 ⟶ enlace covalente.
Esquema de la molécula con la distribución de los electrones (estructura de Lewis):
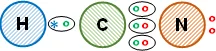
La unión entre los átomos es covalente, todos comparten los electrones de valencia salvo el nitrógeno que no necesita compartir un par. Así, el átomo de hidrógeno cumple con la regla del doblete mediante un enlace covalente simple unido al carbono; el átomo de carbono cumple con la regla del octeto mediante el triple enlace covalente con el nitrógeno y uno simple con el hidrógeno; el átomo de nitrógeno cumple con la regla del octeto mediante el triple enlace covalente con el carbono y sus dos electrones que no comparte. Se obtiene ácido cianhídrico.
e) C₂H₆O
Electrones de valencia del hidrógeno: 1
Electrones de valencia del carbono: 4
Electrones de valencia del oxígeno: 6
Electronegatividad del hidrógeno = 2,20
Electronegatividad del carbono = 2,56
Electronegatividad del oxígeno = 3,37
Son no metales. El carbono es el elemento central.
La diferencia de electronegatividad entre carbono y hidrógeno: 0,36 < 1,70 ⟶ enlace covalente.
La diferencia de electronegatividad entre carbono y oxígeno: 0,81 < 1,70 ⟶ enlace covalente algo polar.
La diferencia de electronegatividad entre hidrógeno y oxígeno: 1,17 < 1,70 ⟶ enlace covalente polar.
Esquema de la molécula con la distribución de los electrones (estructura de Lewis):
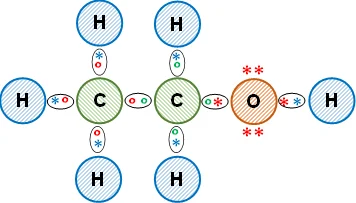
La unión entre los átomos de carbono e hidrógeno es covalente, comparten los electrones de valencia. Entre el carbono y el oxígeno es covalente con tendencia a polar. Entre el oxígeno y el hidrógeno es covalente polar, lo que hace que la molécula sea soluble en agua. Se obtiene etanol (alcohol orgánico).
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo de enlaces covalentes