Problema nº 2 f-j de enlace covalente - TP02
Enunciado del ejercicio nº 2 f-j
Empleando sólo los electrones de valencia y utilizando puntos, asteriscos o cualquier otro símbolo, esquematizar las estructuras electrónicas de las siguientes sustancias:
f) CH₅N
g) CHCl₃
h) CH₃OH
i) CH₃Cl
j) BF₃
Solución
f) CH₅N
Electrones de valencia del hidrógeno: 1
Electrones de valencia del carbono: 4
Electrones de valencia del nitrógeno: 5
Electronegatividad del hidrógeno = 2,20
Electronegatividad del carbono = 2,56
Electronegatividad del nitrógeno = 2,81
Son no metales. El carbono es el elemento central.
La diferencia de electronegatividad entre carbono y hidrógeno: 0,36 < 1,70 ⟶ enlace covalente.
La diferencia de electronegatividad entre carbono y nitrógeno: 0,25 < 1,70 ⟶ enlace covalente.
La diferencia de electronegatividad entre hidrógeno y nitrógeno: 0,61 < 1,70 ⟶ enlace covalente.
Esquema de la molécula con la distribución de los electrones (estructura de Lewis):

La unión entre los átomos de carbono e hidrógeno es covalente simple, comparten los electrones de valencia. Entre el carbono y el nitrógeno es covalente simple. Entre el nitrógeno y el hidrógeno es covalente simple. Se obtiene metilamina (compuesto orgánico).
g) CHCl₃
Electrones de valencia del hidrógeno: 1
Electrones de valencia del carbono: 4
Electrones de valencia del cloro: 7
Electronegatividad del hidrógeno = 2,20
Electronegatividad del carbono = 2,56
Electronegatividad del cloro = 3,00
Son no metales. El carbono es el elemento central.
La diferencia de electronegatividad entre carbono y hidrógeno: 0,36 < 1,70 ⟶ enlace covalente.
La diferencia de electronegatividad entre carbono y cloro: 0,44 < 1,70 ⟶ enlace covalente.
Esquema de la molécula con la distribución de los electrones (estructura de Lewis):
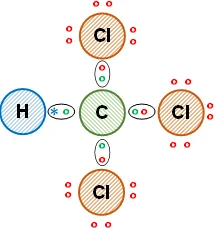
La unión entre el átomo de carbono y el de hidrógeno es covalente simple, comparten un electrón de valencia. Entre el carbono y los átomos de cloro es covalente simple. Se cumple la regla del doblete para el hidrógeno y la regla del octeto para el carbono y cada cloro. A los átomos de cloro le quedan electrones de valencia libres. Se obtiene triclorometano (compuesto orgánico).
h) CH₃OH
Electrones de valencia del hidrógeno: 1
Electrones de valencia del carbono: 4
Electrones de valencia del oxígeno: 6
Electronegatividad del hidrógeno = 2,20
Electronegatividad del carbono = 2,56
Electronegatividad del oxígeno = 3,37
Son no metales. El carbono es el elemento central.
La diferencia de electronegatividad entre carbono y hidrógeno: 0,36 < 1,70 ⟶ enlace covalente.
La diferencia de electronegatividad entre carbono y oxígeno: 0,81 < 1,70 ⟶ enlace covalente algo polar.
La diferencia de electronegatividad entre hidrógeno y oxígeno: 1,17 < 1,70 ⟶ enlace covalente polar.
Esquema de la molécula con la distribución de los electrones (estructura de Lewis):

La unión entre los átomos de carbono e hidrógeno es covalente simple, comparten los electrones de valencia. Entre el carbono y el oxígeno es covalente con tendencia a polar. Entre el oxígeno y el hidrógeno es covalente polar, lo que hace que la molécula sea soluble en agua. Se obtiene metanol (alcohol orgánico).
i) CH₃Cl
Electrones de valencia del hidrógeno: 1
Electrones de valencia del carbono: 4
Electrones de valencia del cloro: 7
Electronegatividad del hidrógeno = 2,20
Electronegatividad del carbono = 2,56
Electronegatividad del cloro = 3,00
Son no metales. El carbono es el elemento central.
La diferencia de electronegatividad entre carbono y hidrógeno: 0,36 < 1,70 ⟶ enlace covalente.
La diferencia de electronegatividad entre carbono y cloro: 0,44 < 1,70 ⟶ enlace covalente.
Esquema de la molécula con la distribución de los electrones (estructura de Lewis):
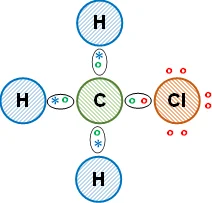
La unión entre el átomo de carbono y los de hidrógeno es covalente simple, comparten un electrón de valencia. Entre el carbono y el átomos de cloro es covalente simple. Se cumple la regla del doblete para el hidrógeno y la regla del octeto para el carbono y el cloro. Al átomo de cloro le quedan electrones de valencia libres. Se obtiene clorometano (compuesto orgánico).
j) BF₃
Electrones de valencia del flúor: 7
Electrones de valencia del boro: 3
Electronegatividad del flúor = 4,00
Electronegatividad del boro = 2,02
Son no metales.
La diferencia de electronegatividad entre flúor y boro: 1,98 > 1,70 ⟶ enlace covalente polar.
Esquema de la molécula con la distribución de los electrones (estructura de Lewis):

La unión entre los átomos de flúor y el de boro es covalente simple, comparten los electrones de valencia. Se cumple la regla del octeto para los átomos de flúor pero no para el boro. Se obtiene trifluoruro de boro.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo de enlaces covalentes