Problema nº 4 de principio de Le Châtelier, variación de la presión y de la temperatura - TP01
Enunciado del ejercicio nº 4
El metanol se fabrica de acuerdo con la siguiente reacción:
CO + 2·H₂ ⇌ CH₃OH + calor
Señalar qué efecto produce en el sistema en equilibrio:
a) Un aumento de la temperatura.
b) Un aumento de la presión.
Solución
a)
La reacción es exotérmica, desprende calor.
Podemos verificarlo tomando los datos de la tabla de entalpías de formación y calcular la entalpía:
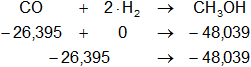
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = -48,039 kcal/mol - (-26,395 kcal/mol)
ΔH = -48,039 kcal/mol + 26,395 kcal/mol
ΔH = -21,644 kcal/mol
La reacción original quedaría:
CO + 2·H₂ ⇌ CH₃OH + 21,644 kcal
Según el principio de Le Châtelier, si se aumenta la temperatura el sistema reaccionará al cambio desprendiendo menos calor y, formando menos metanol.
Respuesta a): disminuye la formación de metanol.
b)
Veamos nuevamente la reacción:
CO + 2·H₂ ⇌ CH₃OH
Es una reacción de formación, todas las sustancias son gaseosas.
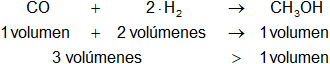
En la reacción intervienen más volúmenes de reactantes que de productos.
Según el principio de Le Châtelier, con el aumento de presión se produce más metanol. La reacción se desplaza hacia la derecha.
![]()
Nótese el cambio de la doble flecha (⇌) por la flecha simple (⟶) en la reacción.
Respuesta b): aumenta la formación de metanol.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo se comporta una reacción con la variación de la presión y de la temperatura