Problema nº 5 de principio de Le Châtelier, variación de la presión, de la temperatura y con un catalizador - TP01
Enunciado del ejercicio nº 5
En un recipiente cerrado a 200 °C y 760 mm Hg de presión, el sistema en equilibrio:
PCl₅ ⇌ Cl₂ + PCl₃ (ΔH = -30 kcal/mol)
Dio la siguiente concentración:
[PCl₃] = [Cl₂] = 0,096 mol/l
[PCl₅] = 0,45 mol/l
Calcular:
a) La constante de equilibrio.
b) El efecto que tiene la concentración de las sustancias en equilibrio ante un aumento de la temperatura.
c) El efecto que tiene la concentración de las sustancias en equilibrio ante una disminución de la presión.
d) El efecto que tiene la concentración de las sustancias en equilibrio ante un aumento de la concentración de PCl₅
e) El efecto que tiene la concentración de las sustancias en equilibrio ante la presencia de un catalizador.
Solución
a)
Expresamos la ecuación equilibrada de la reacción:
![]()
Aplicamos la fórmula de la constante de equilibrio:
![]()
Reemplazamos por los datos y calculamos:
![]()
K = 0,02048
Respuesta a): la constante de equilibrio es 2,05·10⁻².
b)
La reacción es endotérmica, desprende calor dado que ΔH = -30 kcal/mol < 0.
La reacción original quedaría:
PCl₅ ⇌ Cl₂ + PCl₃ - 30 kcal/mol
Según el principio de Le Châtelier, si se aumenta la temperatura el sistema reaccionará al cambio formando más productos.
Respuesta b): disminuye la concentración de PCl₅.
c)
Veamos nuevamente la reacción:
PCl₅ ⇌ Cl₂ + PCl₃
Es una reacción de descomposición, todas las sustancias son gaseosas.
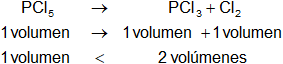
En la reacción intervienen más volúmenes de reactantes que de productos.
Según el principio de Le Châtelier, con el aumento de presión se produce más pentacloruro de fósforo. La reacción se desplaza hacia la izquierda.
![]()
Nótese el cambio de la doble flecha (⇌) por la flecha simple (⟵) en la reacción.
Respuesta c): aumenta la formación de PCl₅.
d)
La reacción, en equilibrio, está planteada como reacción de descomposición con la doble flecha (⇌):
PCl₅ ⇌ Cl₂ + PCl₃
Según el principio de Le Châtelier, el aumento de las concentraciones de los reactantes produce un aumento de los productos de reacción para contrarrestar el aumento de las concentraciones de los reactantes para mantener el equilibrio (mientras no varíe la temperatura). La reacción se desplaza hacia la derecha.
Por lo tanto, si aumenta la concentración de pentacloruro de fósforo aumentará la concentración de cloro y de tricloruro de fósforo.
PCl₅ ⟶ Cl₂ + PCl₃
Nótese el cambio de la doble flecha (⇌) por la flecha simple (⟶) en la reacción.
Respuesta d): aumenta la formación de Cl₂ y PCl₃.
e)
Según el principio de Le Châtelier, los catalizadores no modifican el equilibrio, solamente permiten que el equilibrio se alcance más rápidamente.
Respuesta e): no varía la concentración.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo se comporta una reacción con la variación de la presión, de la temperatura y con un catalizador