Problema nº 6 de entalpía de formación, calor de formación de una reacción - TP04
Enunciado del ejercicio nº 6
Calcular el calor de formación o entalpía de las siguientes reacciones:
a) CH₄ + 2·O₂⟶ CO₂ + 2·H₂O
b) NO + ½·O₂⟶ NO₂
Solución
Dada la reacción equilibrada, buscamos en la tabla de entalpías de formación la entalpía de cada sustancia:
a)
La combustión completa de compuestos orgánicos producen la formación de agua y dióxido de carbono.
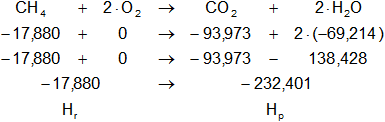
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = -232,401 kcal/mol - (-17,880 kcal/mol)
ΔH = -232,401 kcal/mol + 17,880 kcal/mol
ΔH = -214,521 kcal/mol
Respuesta a): la entalpía de la reacción es -214,521 kcal/mol.
b)
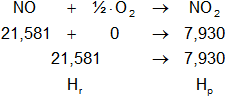
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = 7,930 kcal/mol - 21,581 kcal/mol
ΔH = -13,651 kcal/mol
Respuesta b): la entalpía de la reacción es -13,651 kcal/mol.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo calcular el calor de formación de una reacción