Problema nº 2 de principio de Le Châtelier, variación de la presión, de la concentración y de la temperatura - TP04
Enunciado del ejercicio nº 2
El óxido nítrico (NO) desprende 4,214 kcal/mol, cuando reacciona con oxígeno para dar dióxido de nitrógeno.
2·NO + O₂ ⇌ 2·NO₂ + 4,214 kcal
Predecir el efecto:
a) De elevar la temperatura.
b) Aumentar la presión.
c) Aumentar la concentración de óxido nítrico en el equilibrio.
Solución
a)
La reacción es exotérmica, desprende calor.
Podemos verificarlo tomando los datos de la tabla de entalpías de formación y calcular la entalpía:
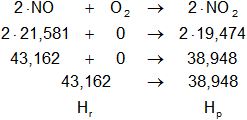
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = 38,948 kcal/mol - 43,162 kcal/mol
ΔH = -4,214 kcal/mol
Según el principio de Le Châtelier, si se aumenta la temperatura en un sistema exotérmico este reaccionará al cambio desprendiendo menos calor y, formando menos óxido nitroso (NO₂).
Respuesta a): disminuye la formación de óxido nitroso.
b)
Veamos nuevamente la reacción:
2·NO + O₂ ⇌ 2·NO₂
Es una reacción de formación, todas las sustancias son gaseosas.
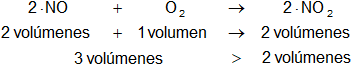
En la reacción intervienen más volúmenes de reactantes que de productos.
Según el principio de Le Châtelier, con el aumento de presión se produce más óxido nitroso. La reacción se desplaza hacia la derecha.
![]()
Nótese el cambio de la doble flecha (⇌) por la flecha simple (⟶) en la reacción.
Respuesta b): aumenta la formación de óxido nitroso.
c)
La reacción, en equilibrio, está planteada como reacción de formación con la doble flecha (⇌):
2·NO + O₂ ⇌ 2·NO₂
Según el principio de Le Châtelier, el aumento de las concentraciones de los reactantes produce un aumento de los productos de reacción para contrarrestar el aumento de las concentraciones de los reactantes para mantener el equilibrio (mientras no varíe la temperatura). La reacción se desplaza hacia la derecha.
Por lo tanto, si aumenta la concentración de óxido nítrico aumentará la concentración de óxido nitroso y disminuirá la concentración de oxígeno.
2·NO + O₂ ⟶ 2·NO₂
Nótese el cambio de la doble flecha (⇌) por la flecha simple (⟶) en la reacción.
Respuesta c): aumenta la formación de óxido nitroso.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo se comporta una reacción con la variación de la presión, de la concentración y de la temperatura