Problema nº 2 de electrólisis. Leyes de Faraday, masa y volumen depositados en un electrodo - TP01
Enunciado del ejercicio nº 2
En una cuba electrolítica que contiene cloruro cúprico fundido se hace pasar una cierta cantidad de corriente durante 3 horas, observando que se deposita cobre metálico en el cátodo y se desprende cloro gaseoso en el ánodo.
a) Determinar la cantidad de corriente necesaria para depositar 20 g de cobre.
b) Calcular el volumen de cloro obtenido a 25 °C y 1 atm.
Desarrollo
Datos:
t = 3 h
m Cu = 20 g
t° = 25 °C
p = 1 atm.
ζCu = 0,000329 g/C *
ζCl = 0,000367 g/C *
Fórmulas:
m = ζ·i·t
Solución
a)
Convertimos las unidades:
t = 3 h = 3 h·3.600 s/h
t = 10.800 s
Aplicamos la primera ley de Faraday:
m = ζCu·i·t
Despejamos i:
![]()
Reemplazamos por los datos y calculamos:
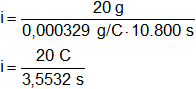
Recordemos que C/s = A.
i = 5,628729033 A
Respuesta a): la corriente requerida es de 5,63 A
b)
Calculamos masa de cloro Cl₂ obtenida con la corriente calculada en el punto anterior.
mCl = ζCl·i·t
Reemplazamos por los datos y calculamos:
mCl = 0,000367 g/C·5,628729033 A·10.800 s
mCl = 22,3100304 g
Este valor es en CNPT, por lo tanto, hallamos los moles de cloro Cl₂:
1 Mol Cl = 2·35,453 g = 70,906 g
![]()
![]()
n = 0,314642349 moles de cloro.
Para hallar el volumen debemos emplear la ecuación de estado de los gases.
p·V = n·R·T
Donde:
R es la constante de los gases.
![]()
T se mide en grados kelvin.
Convertimos las unidades:
T = 25 °C + 273 °C
T = 298 K
Despejamos V:
![]()
Reemplazamos por los datos y calculamos:
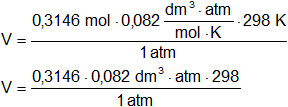
V = 7,688600439 dm³
Respuesta b): el volumen de cloro obtenido es 7,689 dm³.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular la masa y el volumen que se depositan en un electrodo