Problema nº 8 de electrólisis. Leyes de Faraday, tiempo para que un elemento se deposite en un electrodo - TP01
Enunciado del ejercicio nº 8
Una corriente de 5 A se hizo pasar por una solución de cloruro de sodio y se produjo 1 mol de cloro. ¿Qué tiempo se requirió?
Desarrollo
Datos:
i = 5 A
Moles Cl = 1
ζCl = 0,000367 g/C *
Fórmulas:
m = ζ·i·t
Solución
Calculamos el peso molecular del cloro Cl₂:
m = Mol Cl = 2·35,453 g = 70,906 g
Aplicamos la primera ley de Faraday:
m = ζ·i·t
Despejamos t:
![]()
Reemplazamos por los datos y calculamos:
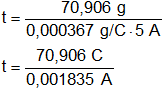
Recordemos que C/A = s.
t = 38.640,87193 s
Respuesta: el tiempo requerido es de 38.641 s.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular el tiempo que demora un elemento en depositarse en un electrodo