Problema nº 4 de equilibrio químico, moles - TP02
Enunciado del ejercicio nº 4
Si K = 8 para la reacción:
2·A + B ⟶ 2·C + D
Establezca la expresión para calcular la concentración de C y D en el equilibrio, si las condiciones iniciales fueron 0,5 mol de A y de B en un recipiente de 10 litros.
Desarrollo
Datos:
K = 8
Moles O = 0,5
Moles N = 0,5
V = 10 l
Solución
La ecuación equilibrada dada:
2·A + B ⟶ 2·C + D
x será el número de moles de C y de D en el equilibrio.
Si se forman x moles de C y x moles de D, desaparecen x moles de A y x moles de B.
Calculamos la concentración de cada compuesto en 10 l.
Para el A:
![]()
Para el B:
![]()
Para el C:
![]()
Para el D:
![]()
En el equilibrio:
![]()
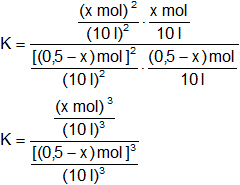
Simplificamos los denominadores y las unidades:

Reemplazamos por los datos y calculamos:
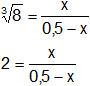
2·(0,5 - x) = x
1 - 2·x = x
Despejamos x:
x + 2·x = 1
3·x = 1
x = ⅓
Respuesta: la cantidad de moles de C y de D que hay en el sistema es ⅓
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo, cómo calcular los moles dada la constante de equilibrio